Nat Immunol:“垃圾DNA”—逆转录转座子或是一把双刃剑!既能诱导肿瘤发生还能引发癌细胞死亡!
来源:本站原创 2021-10-28 10:50
来自美国罗彻斯特大学等机构的科学家们通过研究揭示了诱发肿瘤的自私遗传元件引发癌细胞死亡的分子机制。
2021年10月27日 讯 /生物谷BIOON/ --盲鼹鼠(BMRs)是一种小型啮齿动物,其寿命特别长,能超过21年,而且对自发和诱导的肿瘤发生都有一定的抵抗力。近日,一篇发表在国际杂志Nature Immunology上题为“Transposon-triggered innate immune response confers cancer resistance to the blind mole rat”的研究报告中,来自美国罗彻斯特大学等机构的科学家们通过研究揭示了诱发肿瘤的自私遗传元件引发癌细胞死亡的分子机制。
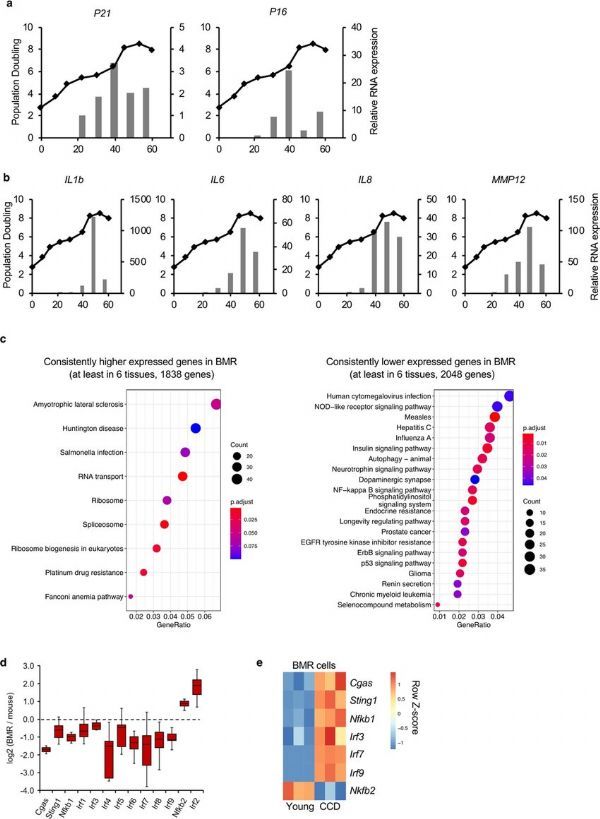
过度增殖的BMR细胞中SASP的激活及BMR和小鼠组织中基因的差异表达。
图片来源:Zhao, Y., et al. Nat Immunol 22, 1219–1230 (2021). doi:10.1038/s41590-021-01027-8
这种自私的遗传元件曾经被认为只是基因组中的“寄生虫”,但本文中研究人员发现,这种所谓的垃圾DNA实际上对预防肿瘤发生至关重要。研究者发现,盲鼹鼠能利用称之为逆转录转座子(retrotransposons)的自私遗传元件来保护自身免于癌症侵害,相关研究结果或为杀灭癌细胞提供了一种新的机制,同时也有望帮助开发治疗人类癌症的新型抗癌疗法。逆转录转座子元件在传统上被认为是一种会带来癌症风险会加速老化的诱变剂,然而最新研究表明,其实际上还会抑制肿瘤的发生。
人类基因组中充满了自私的遗传元件,即重复性的元件,其似乎对宿主并没有什么益处,而只是通过将新的拷贝插入到宿主基因组中来进行自我复制。逆转录转座子是人类机体中发现的最普遍的自私遗传元件,大约45%的人类基因组都是由这种逆转录转座子所组成的,这些自私的遗传元件或许是古代病毒的残留物,会引起有害的突变和炎症,这些就是年龄相关疾病的标志物。然而,正如研究人员在文章中报道的那样,逆转录转座子或许是一把双刃剑,如果不加控制的话,其就会在基因组中造成破坏,但同时其还能触发特殊机制来杀灭快速增殖的细胞,这类细胞会导致肿瘤产生。
研究者Gorbunova说道,几十年来,人们一直关注逆转录转座子诱发肿瘤坏的一面,因为转座子的活性在肿瘤中往往更高,而本文研究结果表明,这种升高的转座子活性实际上是机体用来识别并杀灭癌变细胞的方式。关键在于维持激活和抑制逆转录转座子之间的平衡,研究者将其比喻为训练一条警犬,如果你想训练一条警犬提醒你并帮助抵御入侵者,但你同时也希望警犬不要盲目地腰上与其接触的每个人。
长期以来,研究人员一直在寿命较长的动物中研究长寿与抗病能力之间的关联,他们重点对啮齿类动物进行研究,因为其基因与人类机体的基因相似,而且有不同的寿命;理解为何特定的啮齿类动物能够抗癌的原因或能为科学家们提供线索来揭开有望应用于人类机体中的抗癌机制。盲鼹鼠就是其中一种啮齿类动物,其一生都在地下洞穴中度过,通常其能存活21年,这几乎是同尺寸提醒小鼠寿命的5倍,而其长寿通常也归因于对癌症和其它年龄相关疾病存在显著的抵抗力。
此前研究人员通过研究发现,盲鼹鼠能通过激活一种“协同性的细胞死亡”机制来预防癌症,但这种机制到目前依然是一个谜题;这篇研究报告中,研究人员认为,逆转录转座子或许就是揭开这一谜题的关键部分,因为盲鼹鼠能进化地利用逆转录转座子杀灭癌细胞。实际上,盲鼹鼠机体能自然表达一种较低水平的酶类—DNA甲基转移酶1(DNMT1),当细胞分裂后,DNMT1就会修饰每一条DNA链来控制基因表达,包括沉默逆转录转座子的功能;如果细胞复制过快的话(正如癌细胞的情况),其拥有较低水平的DNMT1就意味着DNMT1的水平无法跟上,而且逆转录转座子就会更加活跃;在盲鼹鼠的例子中,这或许就是一件好事情,逆转录转座子会通过在细胞质中积累而模拟病毒感染的过程,从而就会诱发免疫反应并杀灭正在快速繁殖的细胞。
图片来源:https://www.nature.com/articles/s41590-021-01027-8
最初,科学家们认为,利用逆转录转座子的机制是盲鼹鼠所特有的,然而本文研究结果表明,人类组织细胞中似乎也存在相同的机制,当降低人类机体中DNMT1的水平或增强逆转录转座子的激活时,其就会杀灭快速繁殖的癌细胞。当然了,科学家们仍然需要阐明盲鼹鼠到底是如何实现激活和抑制逆转录转座子这两个过程之间平衡的;未来研究者或许就更加专注于研究这种自私遗传元件的作用了。
尽管目前人类尚未进化地像盲鼹鼠一样利用逆转录转座子,但本文研究表明,相类似的机制或许也存在于人类机体中。而研究者正能利用这一信息通过开发更具选择性的疗法,增强已经存在的细胞机制和过程,从而来实现抑制癌细胞生长的目的。综上,本文研究结果表明,逆转录转座子元件(RTEs)或许是一把双刃剑,其既能作为一种肿瘤抑制子,还能通过诱导无菌的炎性反应来促进晚年机体的衰老。(生物谷Bioon.com)
原始出处:
Zhao, Y., Oreskovic, E., Zhang, Q. et al. Transposon-triggered innate immune response confers cancer resistance to the blind mole rat. Nat Immunol 22, 1219–1230 (2021). doi:10.1038/s41590-021-01027-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。