首个治疗斑秃的JAK抑制剂!欧盟CHMP推荐批准Olumiant(巴瑞替尼):显著促进头发再生!
来源:生物谷原创 2022-05-25 13:42
Olumiant有潜力成为美国和欧盟首个用于治疗斑秃(AA)的JAK抑制剂。
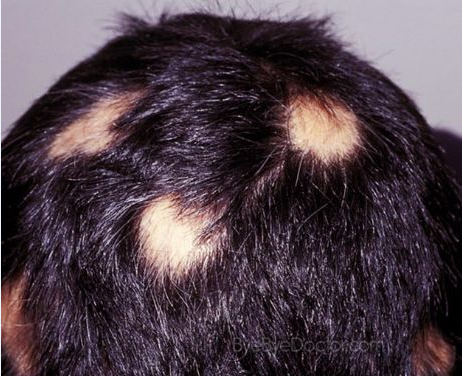
斑秃(图片来源:byebyedoctor.com)
2022年05月25日讯 /生物谷BIOON/ --礼来(Eli Lilly)与合作伙伴Incyte近日联合宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,推荐批准口服JAK抑制剂Olumiant(中文商品名:艾乐明,通用名:baricitinib,巴瑞替尼),用于治疗成人重度斑秃(alopecia areata,AA)。
现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计将在未来2个月内做出最终审查决定。目前,Olumiant治疗重度AA的新适应症申请也正在接受美国FDA的优先审查。在2020年,FDA授予了Olumiant治疗AA的突破性疗法认定(BTD)。如果获得批准,Olumiant将成为美国和欧盟首个用于治疗斑秃(AA)的JAK抑制剂。
斑秃(AA)是一种自身免疫性疾病,该病是由于免疫系统对毛囊进行攻击,导致头皮、面部、身体其他部位出现毛发部分或完全脱落,该病同时还会对患者的心理产生重大影响。
Olumiant是一种每日口服一次的选择性、可逆性JAK1和JAK2抑制剂,开发用于治疗多种炎症性疾病和自身免疫性疾病。Olumiant由Incyte发现并授权给礼来,该药已在全球70多个国家被批准用于治疗中度至重度活动性类风湿性关节炎(RA)成人患者、在50多个国家被批准用于治疗中度至重度特应性皮炎(AD)成人患者。
2022年5月,Olumiant还获得了美国FDA批准,用于治疗需要补氧、无创或有创机械通气、或体外膜肺氧合(ECMO)的住院COVID-19成人患者。值得一提的是,Olumiant是美国FDA批准的第一种也是唯一一种用于治疗需要不同程度氧支持的特定住院COVID-19成人患者的JAK抑制剂。
CHMP的积极审查意见,基于3期BRAVE-AA试验项目的数据。该项目是已完成主要终点的最大规模斑秃3期临床试验项目,包括2项3期临床试验(BRAVE-AA1和BRAVE-AA2),在1200名重度AA患者中评估了Olumiant的疗效和安全性。重度斑秃定义为脱发严重程度工具(SALT)评分≥50(≥50%头皮脱发)。主要终点是治疗第36周达到SALT≤20(即头皮毛发覆盖率≥80%)的患者比例。
2项研究的结果显示,治疗第36周,Olumiant 4mg组有三分之一的患者实现头皮毛发覆盖率≥80%(BRAVE-AA1研究:35.2%[n=99];BRAVE-AA2研究:32.5%[n=76]),而安慰剂组分别为二十分之一(BRAVE-AA1研究:5.3%[n=10])、五十分之一(BRAVE-AA2研究:2.6%[n=4])的患者达到这一目标(与安慰剂的所有比较均为p≤0.001)。
此外,对于基线时有明显缺失或无明显眉毛或睫毛的患者,治疗第36周时,Olumiant 4mg组有三分之一的患者也观察到眉毛或睫毛完全再生或无明显缺失的再生(BRAVE-AA1研究:4mg组:眉毛=31.4%[n=59],睫毛=33.5%[n=56];安慰剂组:眉毛=3.2%[n=4],睫毛=3.1%[n=3];BRAVE-AA2研究:4mg组:眉毛=34.8%[n=56],睫毛=34.3%[n=48];安慰剂组:眉毛=4.5%[n=5];睫毛=5.6%[n=5];与安慰剂的所有比较均为p≤0.001)。
3期BRAVE-AA临床项目也评估了Olumiant的安全性,未观察到新的安全信号。很少有患者因不良事件中断治疗(2项研究中的不良事件发生率均≤2.6%),且大多数因治疗引起的不良事件的严重程度为轻度或中度。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


