《自然·代谢》:复旦中山医院/西北工业大学团队揭示,老牌降糖药阿卡波糖能借助肠道微生物,增援免疫治疗!
来源:网络 2024-10-10 09:31
研究显示婴儿双歧杆菌(B. infantis)是参与影响阿卡波糖增敏免疫治疗的关键微生物。
近日,复旦大学附属中山医院王志明、王妍、张世龙等人与西北工业大学医学研究院贾庆安等国内研究者合作,在Nature Metabolism期刊发表了最新研究成果,揭示老牌降糖药阿卡波糖可使特定肠道微生物代谢色氨酸、产生代谢物吲哚乙酸的能力增强,进而上调趋化因子CXCL10-CXCR3通路,改善CD8+T细胞向肿瘤部位的募集,从而增敏免疫治疗[1]。

论文首页截图
阿卡波糖能调节肠道菌群其实并不算意外,毕竟它的降糖作用机制是抑制肠道对碳水化合物的吸收,同为肠道居民的肠道微生物必然会受影响[2],但再叠加肿瘤乃至免疫治疗时的情况还是个未知数,所以研究者们一上来就先用不同剂量的阿卡波糖处理荷瘤小鼠,评估肠道微生物的变化,有意思的是,只有中间剂量(500mg/kg)阿卡波糖处理会导致显著改变。
研究者们就选用中间剂量阿卡波糖,用于后续实验的处理和分析,发现既往研究报告的、与免疫治疗效果有关的双歧杆菌、乳杆菌等菌群,都在阿卡波糖处理后明显增多,而且虽然阿卡波糖单独使用没什么抑癌效应,但联合PD-1抑制剂就有显著疗效了,且联合治疗后的小鼠肠道微生物也向着“更健康”的方向改变,不过真正的功臣和关键起效机制是什么呢?
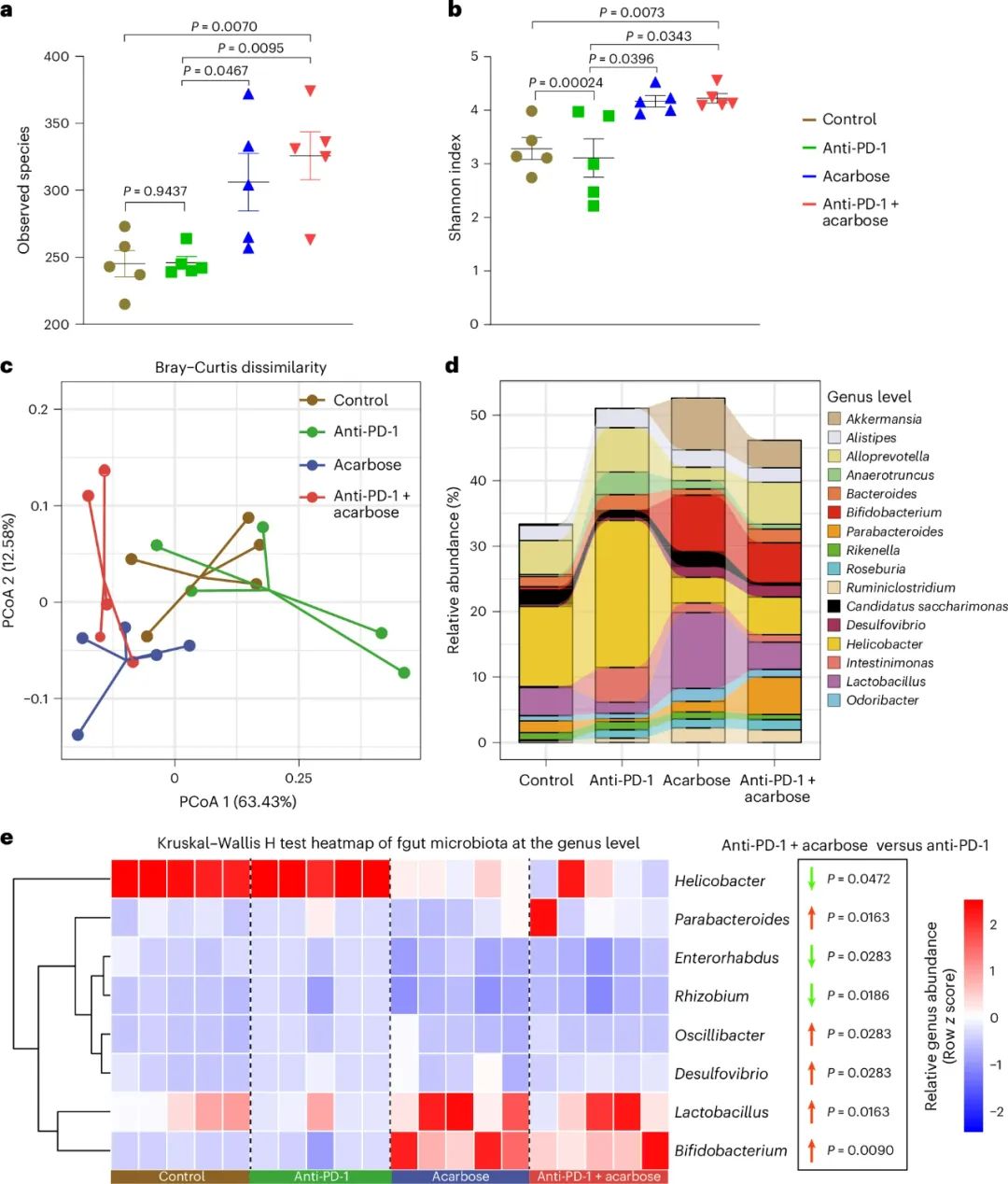
阿卡波糖联合PD-1抑制剂治疗,会显著改变肠道微生物构成
基因集富集分析首先提示,阿卡波糖联合PD-1抑制剂治疗处理后,肿瘤内与淋巴细胞激活、T细胞迁移有关的基因表达显著上调,符合免疫应答更好的状态,同时阿卡波糖增敏免疫治疗的功效也是CD8+T细胞依赖性的;而联合肠道微生物变化进行分析时,研究者们明确了CXCL10等关键趋化因子的表达水平,与部分肠道微生物的存在直接相关。
结合这些发现,研究者们推测阿卡波糖可能是借助调节肠道微生物,使CXCL10等关键趋化因子上调,介导更多的CD8+T细胞浸润到肿瘤部位,并借助TCGA数据库资料和实验确认,起关键作用的就是CXCL10与其相应配体CXCR3,将它们阻断就会使阿卡波糖的作用消失。那肠道微生物那边的帮手是谁呢?得从微生物的代谢产物入手分析了。
分析显示,在阿卡波糖处理导致的代谢产物广泛改变中,色氨酸代谢与阿卡波糖联合PD-1抑制剂治疗后的应答关系最密切,而色氨酸代谢产物中,又数吲哚乙酸(IAA)与CXCL10等趋化因子水平变化的相关性最明显;验证性实验结论也显示,单独用IAA处理就能起到与阿卡波糖相似的增敏免疫治疗效应,不过研究者们没能直接明确IAA的最主要来源,但研究也显示婴儿双歧杆菌(B. infantis)是参与影响阿卡波糖增敏免疫治疗的关键微生物。
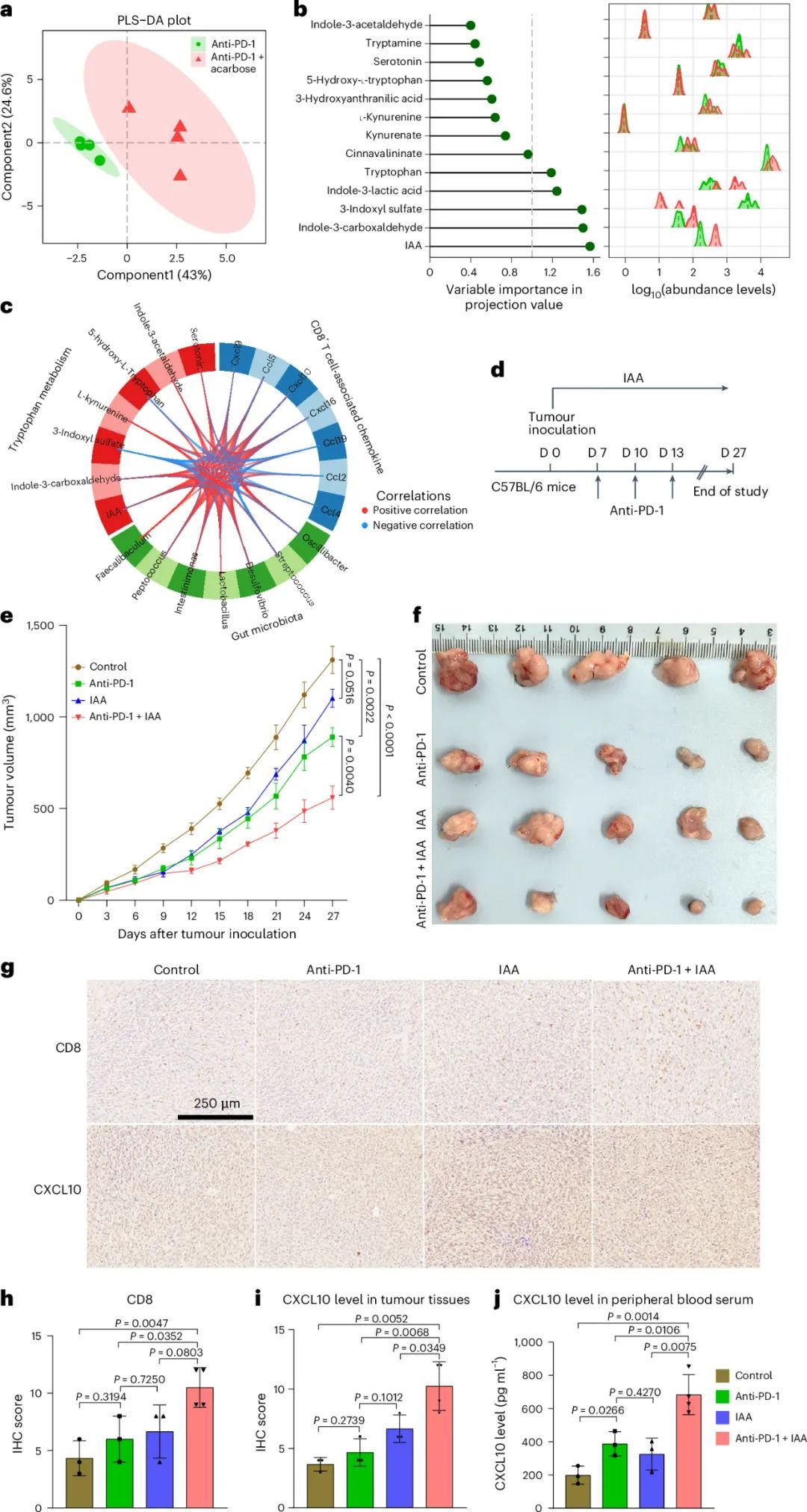
吲哚乙酸对阿卡波糖介导的增敏免疫治疗不可或缺
相比粪菌移植等调控肠道微生物助力免疫治疗的方法,口服阿卡波糖实在是简单又好接受太多啦,不过研究者们也指出,阿卡波糖的影响可能还很大程度上受到基线时微生物构成、肿瘤类别乃至物种区隔的影响,所以还得用后续研究来进一步验证它实际的临床价值,各位可别看完文章就急着去用它,再怎么说也得问问内分泌科哦。
参考文献:
[1]Zhang S L, Wang X, Cai Q Q, et al. Acarbose enhances the efficacy of immunotherapy against solid tumours by modulating the gut microbiota[J]. Nature Metabolism, 2024.
[2]Tan K, Tesar C, Wilton R, et al. Interaction of antidiabetic α‐glucosidase inhibitors and gut bacteria α‐glucosidase[J]. Protein Science, 2018, 27(8): 1498-1508.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


