《细胞》子刊:高血糖降解抑癌蛋白!中国科学家首次发现,糖尿病级别的葡萄糖浓度,会在1小时内强烈破坏p53的稳定性
来源:奇点糕 2023-07-14 16:36
饶枫/赵丽/王凤超等人的研究发现了糖尿病等代谢性疾病促进癌症发生的全新机制,让我们对糖尿病促癌有了新的认知。更重要的是,这个研究还提供了此类癌症治疗的靶点。
众所周知,糖尿病是癌症的风险因素。
无论是1型糖尿病,还是2型糖尿病,都会增加许多类型癌症的风险[1,2]。然而,糖尿病促进癌症发生的分子机制,目前还没有完全搞清楚。
近日,由南方科技大学饶枫、天津医科大学赵丽和北京生命科学研究所王凤超领衔的研究团队,在著名期刊《分子细胞》上发表一项重磅研究成果[3],揭示了葡萄糖的一个出人意料的功能。
他们发现,葡萄糖竟然可以通过一套复杂而精密的流程,促进抑癌蛋白p53的降解,进而加强癌细胞对葡萄糖的摄取和糖酵解,促进癌症的进展。
让人吃惊的是,糖尿病级别的葡萄糖浓度(>8mM),竟会在短短1小时内强烈破坏p53的稳定性。南方科技大学的苏杨和骆怡帆为本论文的共同第一作者。

论文首页截图
为了探索葡萄糖对癌细胞的影响,研究人员先用葡萄糖处理人乳腺癌细胞系MCF7和人结肠癌细胞系HCT116,观察两种癌细胞系转录组的变化。
初步研究结果表明,葡萄糖有可能通过转录重编程,促进癌细胞对葡萄糖的摄取以及糖酵解。简单地说,癌细胞对葡萄糖“上瘾”了,摄入葡萄糖会进一步促进它对葡萄糖的需求。难怪癌细胞增殖那么快,这不就是“填鸭式”增殖么。
基因富集分析将p53蛋白指定为葡萄糖诱导转录重编程的重要调节因子。查阅相关文献资料后,研究人员发现,原来早就有研究发现,本研究中发现的许多葡萄糖反应性糖酵解转录物都是由p53调节的[4]。随后,他们围绕p53及下游信号蛋白开展了一系列研究,发现葡萄糖可以抵消掉p53的抗糖酵解作用。
我们都知道,有氧糖酵解是癌症的一大典型特征[5],p53作为一种代谢抑制剂,是可以抑制癌症的糖酵解的[4,6,7]。而饶枫等人的研究却发现,葡萄糖可以解除p53蛋白的这一功能。难怪高血糖可以促癌。

研究数据都指向p53
那么葡萄糖究竟有何神通,竟然能消除抑癌蛋白p53的功能。
研究结果出人意料。
如果停止给癌细胞供应葡萄糖,癌细胞中的p53蛋白会随着时间的推移不断积累;而一旦恢复葡萄糖的供应,癌细胞中的p53蛋白水平就会减少。
最让人吃惊的是,糖尿病级别的葡萄糖浓度(>8mM)竟会在短短1小时内强烈破坏p53蛋白的稳定性。值得注意的是,无论是停止还是恢复葡萄糖供应,都不会影响p53的mRNA水平。以上数据说明,葡萄糖浓度的变化影响了p53蛋白的稳定性。
事实确实如此,后续研究证实,葡萄糖促进了p53的泛素化和蛋白酶体依赖性降解,小鼠模型研究也证实了这一发现。
原来,葡萄糖组织“人手”把抑癌蛋白p53干掉了!
这太出人意料了。
那么这个过程究竟是如何发生的呢?
饶枫团队开展了全面且深入的研究,最后发现,高浓度的葡萄糖通过一系列的调节过程,促进了CRL4COP1 E3连接酶的组装,加速了p53蛋白的泛素化降解,进而促进癌细胞对葡萄糖的摄入和糖酵解,最终实现促进癌细胞的增殖和进展。
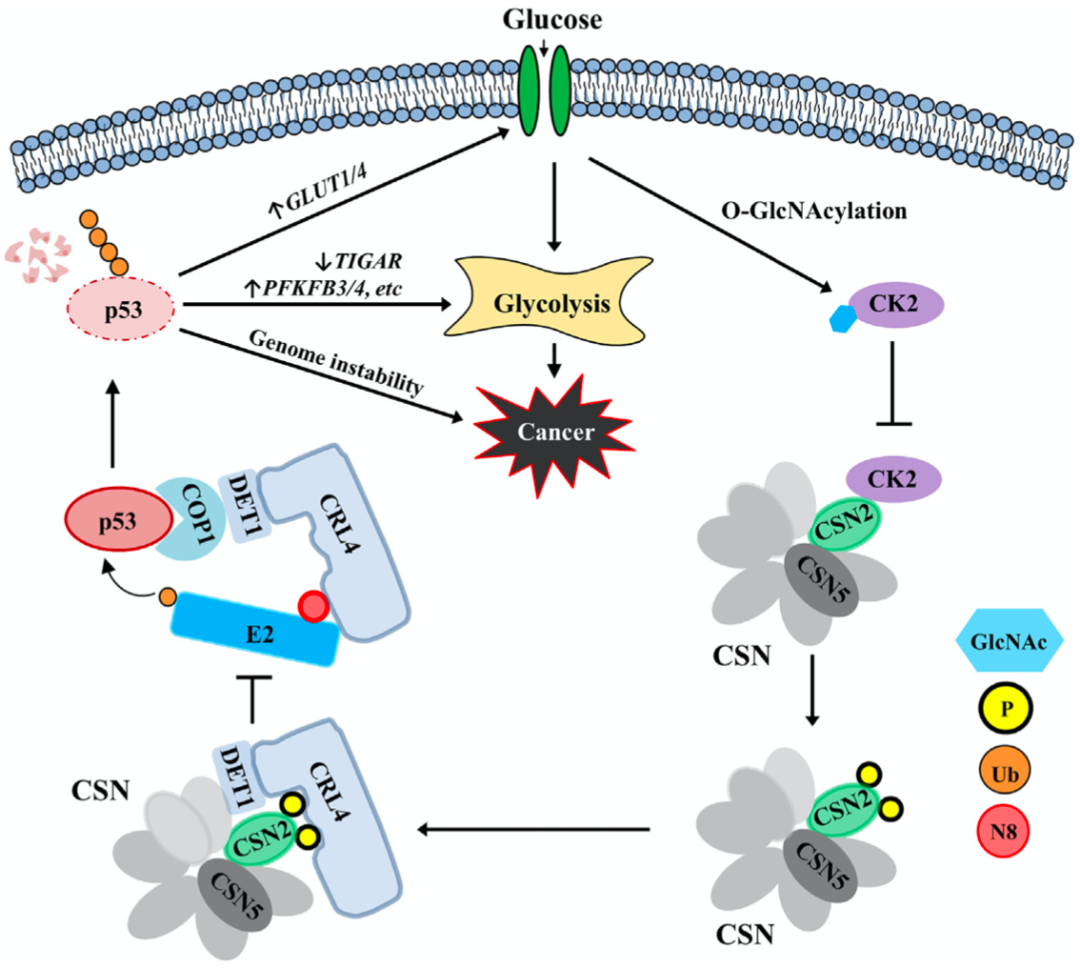
机制示意图
在研究的最后,研究人员在高脂饮食诱导的糖尿病小鼠模型中确认了上述机制的存在。
研究结果表明,与喂养正常饲料(NCD)的小鼠相比,高脂饮食(HFD)小鼠的CRL4COP1 E3组装水平升高,p53蛋白的水平显著下降,而mRNA水平没有显著变化,于此同时肿瘤细胞的增殖水平很高。
在乳腺上皮细胞p53缺失的小鼠模型中,虽然正常饮食条件下,小鼠的乳腺肿瘤生长加速,但是高脂饮食喂养不再进一步促进肿瘤的生长和增殖。此外,阻止COP1和p53相互作用的药物p28,也可抑制高脂饮食的促癌作用。这些数据表明,高脂饮食主要通过上调CRL4COP1-p53轴诱导促肿瘤性转录重编程。
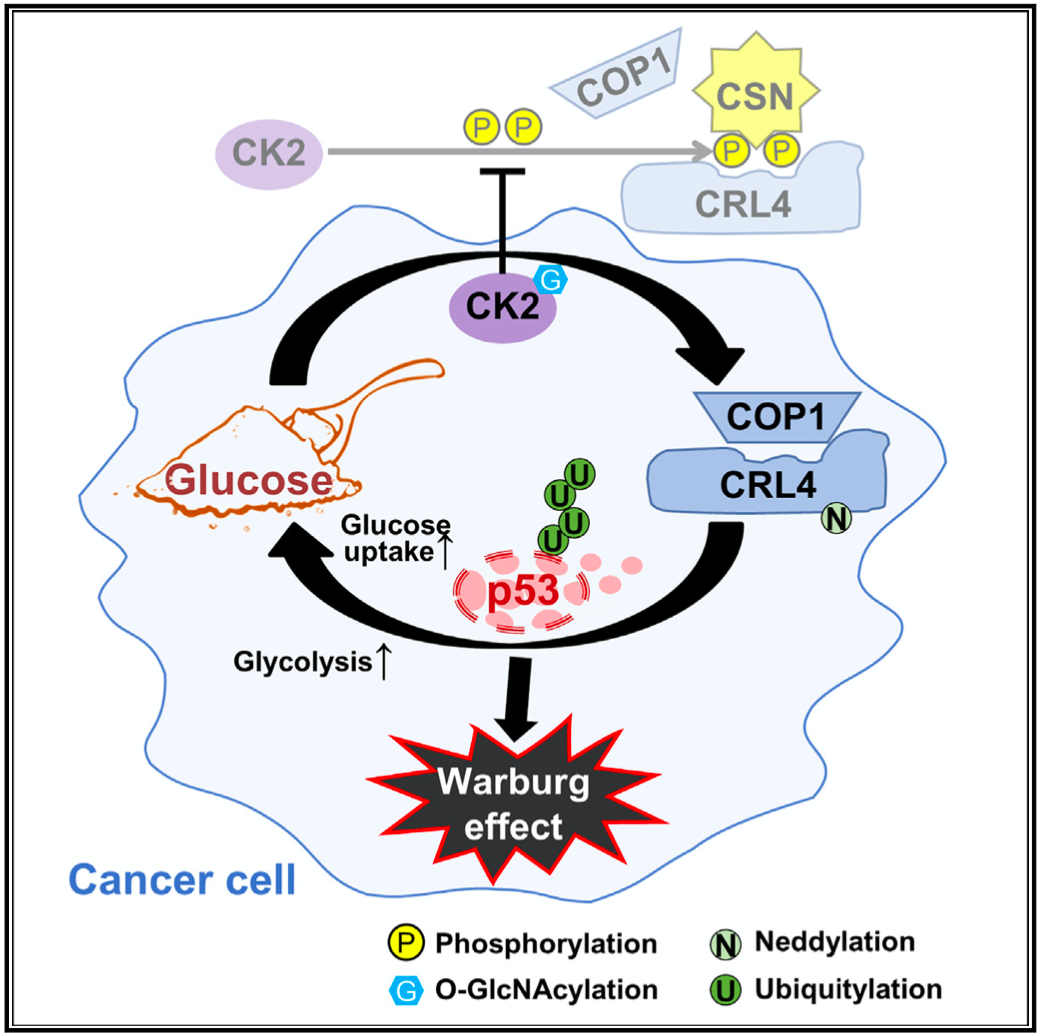
总的来说,饶枫/赵丽/王凤超等人的研究发现了糖尿病等代谢性疾病促进癌症发生的全新机制,让我们对糖尿病促癌有了新的认知。更重要的是,这个研究还提供了此类癌症治疗的靶点。
写完这篇文章的时候,我突然想起来,这不是第一次发现高血糖促进抑癌蛋白的降解了。实际上,早在2018年复旦大学石雨江团队就发现,高血糖也会促进抑癌蛋白TET2的降解,导致促癌基因的高表达,最终促进癌症的进展[8]。
不管怎样,我还是会劝下大家“管住嘴、迈开腿”,管理好自己的血糖,毕竟目前看来,高血糖至少可以促进两个重要抑癌蛋白的降解,这可不是闹着玩儿的。
参考文献:
[1].Carstensen B, Read SH, Friis S, et al. Cancer incidence in persons with type 1 diabetes: a five-country study of 9,000 cancers in type 1 diabetic individuals. Diabetologia. 2016;59(5):980-988. doi:10.1007/s00125-016-3884-9
[2].Hu Y, Zhang X, Ma Y, et al. Incident Type 2 Diabetes Duration and Cancer Risk: A Prospective Study in Two US Cohorts. J Natl Cancer Inst. 2021;113(4):381-389. doi:10.1093/jnci/djaa141
[3].Su Y, Luo Y, Zhang P, et al. Glucose-induced CRL4COP1-p53 axis amplifies glycometabolism to drive tumorigenesis. Mol Cell. 2023;S1097-2765(23)00432-X. doi:10.1016/j.molcel.2023.06.010
[4].Liu Y, Gu W. The complexity of p53-mediated metabolic regulation in tumor suppression. Semin Cancer Biol. 2022;85:4-32. doi:10.1016/j.semcancer.2021.03.010
[5].Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646-674. doi:10.1016/j.cell.2011.02.013
[6].Labuschagne CF, Zani F, Vousden KH. Control of metabolism by p53 - Cancer and beyond. Biochim Biophys Acta Rev Cancer. 2018;1870(1):32-42. doi:10.1016/j.bbcan.2018.06.001
[7].Lacroix M, Riscal R, Arena G, Linares LK, Le Cam L. Metabolic functions of the tumor suppressor p53: Implications in normal physiology, metabolic disorders, and cancer. Mol Metab. 2020;33:2-22. doi:10.1016/j.molmet.2019.10.002
[8].Wu D, Hu D, Chen H, et al. Glucose-regulated phosphorylation of TET2 by AMPK reveals a pathway linking diabetes to cancer. Nature. 2018;559(7715):637-641. doi:10.1038/s41586-018-0350-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


