《神经元》:首个人脑研究显示,突触中低聚体tau或是阿尔茨海默病tau病理扩散的罪魁祸首!
来源:奇点糕 2023-06-09 15:06
这个研究基于阿尔茨海默病患者的脑样本,深入研究了低聚体tau,发现突触中的低聚体tau可能是tau病理在阿尔茨海默病患者大脑中扩散的罪魁祸首。
阿尔茨海默病tau病理的扩散机制,又有了新发现。
近日,由英国爱丁堡大学Tara L. Spires-Jones和西班牙巴塞罗那自治大学Alberto Lleó领衔的研究团队,在著名期刊《神经元》上发表重要研究成果[1]。
他们基于阿尔茨海默病患者和健康人脑样本,对下颞皮层的1315583个兴奋性突触对进行了成像,发现突触前末端和突触后末端均存在低聚体tau,甚至在没有大量纤维状tau沉积的区域也有低聚体tau。而且,在突触末端中,与磷酸化或错误折叠的tau相比,低聚体tau的比例更高。
基于以上发现,他们认为突触中低聚体tau积累是阿尔茨海默病病理的一个早期事件,而且低聚体tau有可能是通过突触传播在大脑中扩散。因此,减少突触中低聚体tau可能是治疗阿尔茨海默病的一个有前途的策略。
据了解,这也是科学家首次对人脑突触低聚体tau展开全面的可视化研究。

论文首页截图
众所周知,在阿尔茨海默病的神经病理学特征中,突触受损是认知能力下降的最强相关因素,而tau病理又与突触受损和认知症状密切相关。
虽然磷酸化tau、错误折叠的tau和低聚体tau都被认为与突触功能障碍和突触丧失有关;但是Spires-Jones等注意到,学界对人脑突触tau,特别是低聚体tau,知之甚少。他们认为这是一个需要填补的重要学术空白。
为了填补上这个空白,他们收集了24名阿尔茨海默病患者和19名非阿尔茨海默病患者死后的大脑样本,然后用阵列层析成像技术(AT)开展了高分辨率三维成像,研究了下颞皮层的1315583个兴奋性突触对。他们发现,与对照组相比,阿尔茨海默病患者的兴奋性突触密度下降了1.25倍。
随后,他们通过抗体标记的方式,调查了突触后末端tau的存在情况。低聚体tau用T22抗体,错误折叠的tau用Alz50抗体,Ser202/Thr205磷酸化tau用AT8抗体标记。
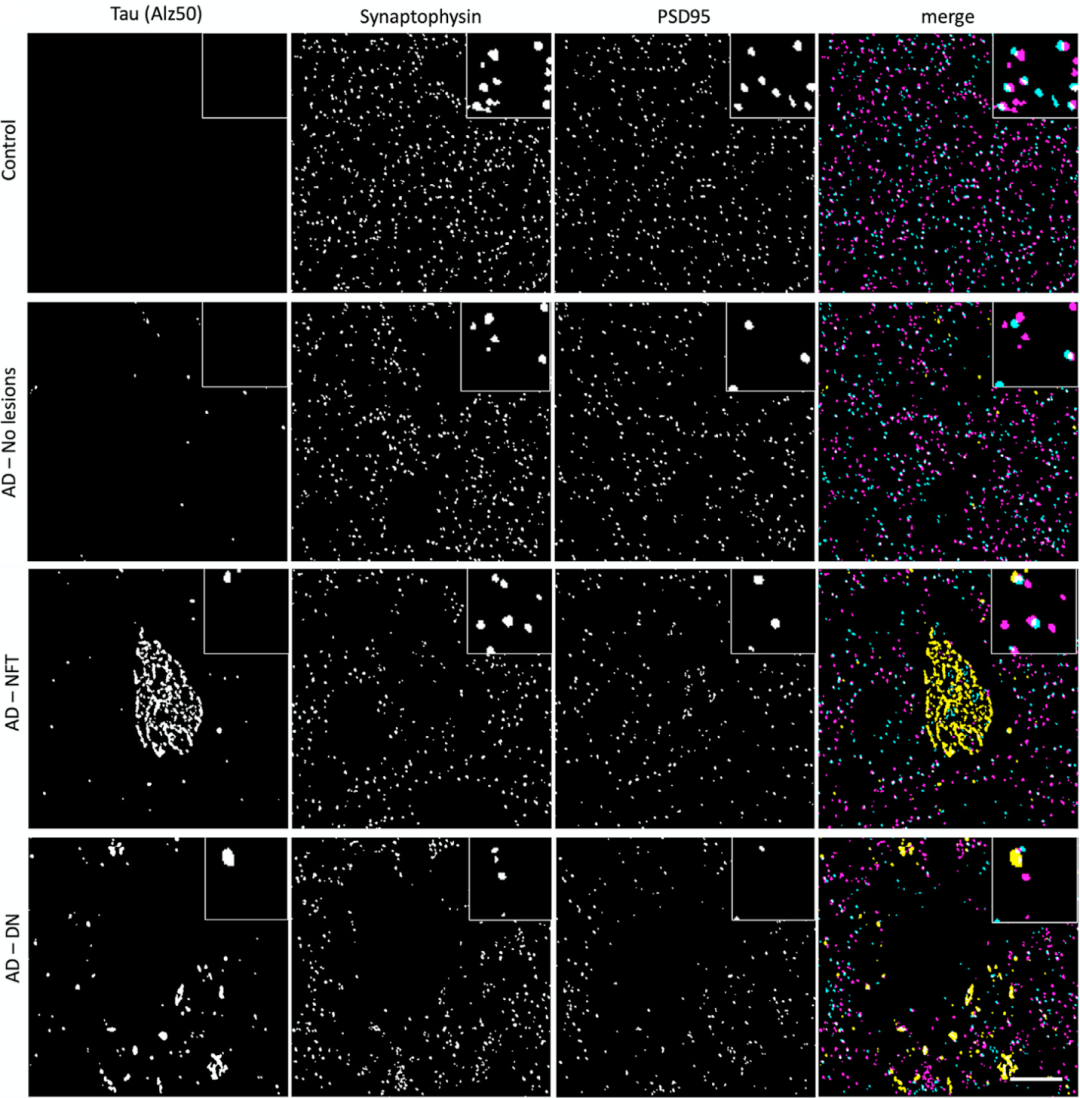
最后一列的彩色图中:洋红是突触前末端,青色是突触后末端,黄色是错误折叠的tau
他们在阿尔茨海默病患者样本的突触后末端中发现了三种tau,不过被T22标记的低聚体tau比另外两种tau更多。有趣的是,T22和AT8经常出现在同一个突触后末端,而Alz50则主要出现在不同突触上。
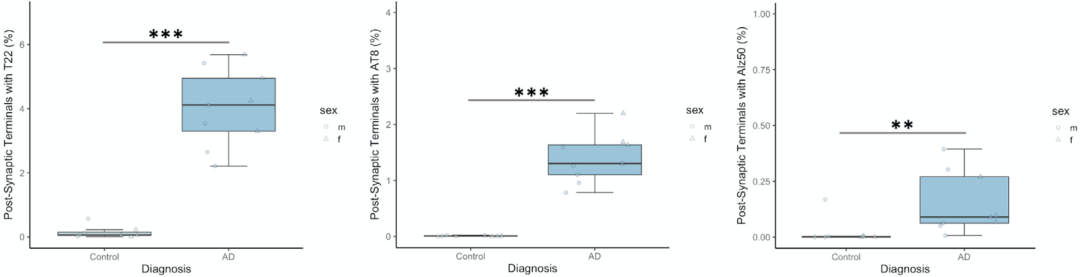
低聚体tau更多
Spires-Jones团队还发现,被PSD95标记的突触后末端的大小和信号强度都与tau的种类有关,其中低聚体tau(T22标记)的存在与突触后末端的大小和信号强度增加最多有关。
至于背后原因,他们认为这可能是突触受伤后发生的补偿现象,之前也有研究提到了类似的现象[2,3]。这也意味着,低聚体tau对突触的伤害可能更大。
他们还借助于其他成像技术,证实了突触中确实存在低聚体tau。

免疫金电微镜成像结果
接下来,Spires-Jones团队要探索的问题是,低聚体tau是不是阿尔茨海默病病理的早期事件。为此,他们检查了神经纤维缠结和突触低聚体tau之间的关系。
他们发现,在没有神经纤维缠结或神经纤维缠结数量较少的区域,无论是对照组样本,还是阿尔茨海默病患者样本,突触前末端都有低聚物tau积累。而且,神经纤维缠结和低聚体tau的总量之间存在正相关,尤其是在受tau病理影响较大的脑区。
在将T22标记的低聚体tau与AT180标记的231残基磷酸化tau(据报道是tau病理的早期标志物[4])做比较之后,发现虽然这两种类型的tau在阿尔茨海默病患者的突触都普遍存在,但是T22标记的突触前末端比AT180标记的多3.3倍。
在研究的最后,他们找到了低聚物tau沿突触正向传播的间接证据:顺着神经信号传递的方向,低聚体tau的浓度逐渐降低。小鼠模型的研究,证实了这一推测。
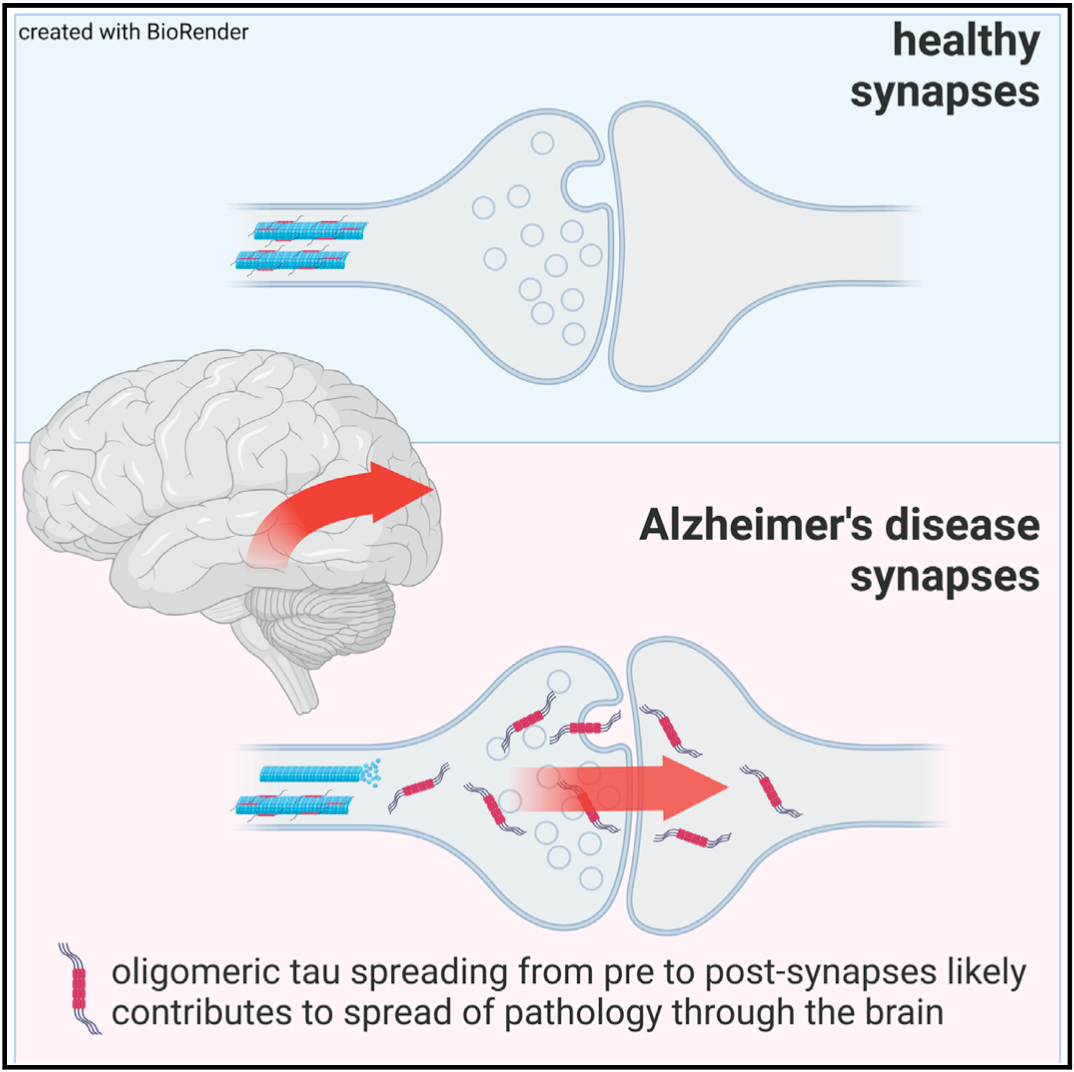
低聚体tau在大脑中的散播
总的来说,这个研究基于阿尔茨海默病患者的脑样本,深入研究了低聚体tau,发现突触中的低聚体tau可能是tau病理在阿尔茨海默病患者大脑中扩散的罪魁祸首。
这个研究提示,靶向低聚体tau可能是治疗阿尔茨海默病的一种有效方法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


