Cancer Cell:秦骏/梁朝朝/袁怀瑞/董樑团队揭示双阴性前列腺癌耐药新机制
来源:生物世界 2025-04-30 09:42
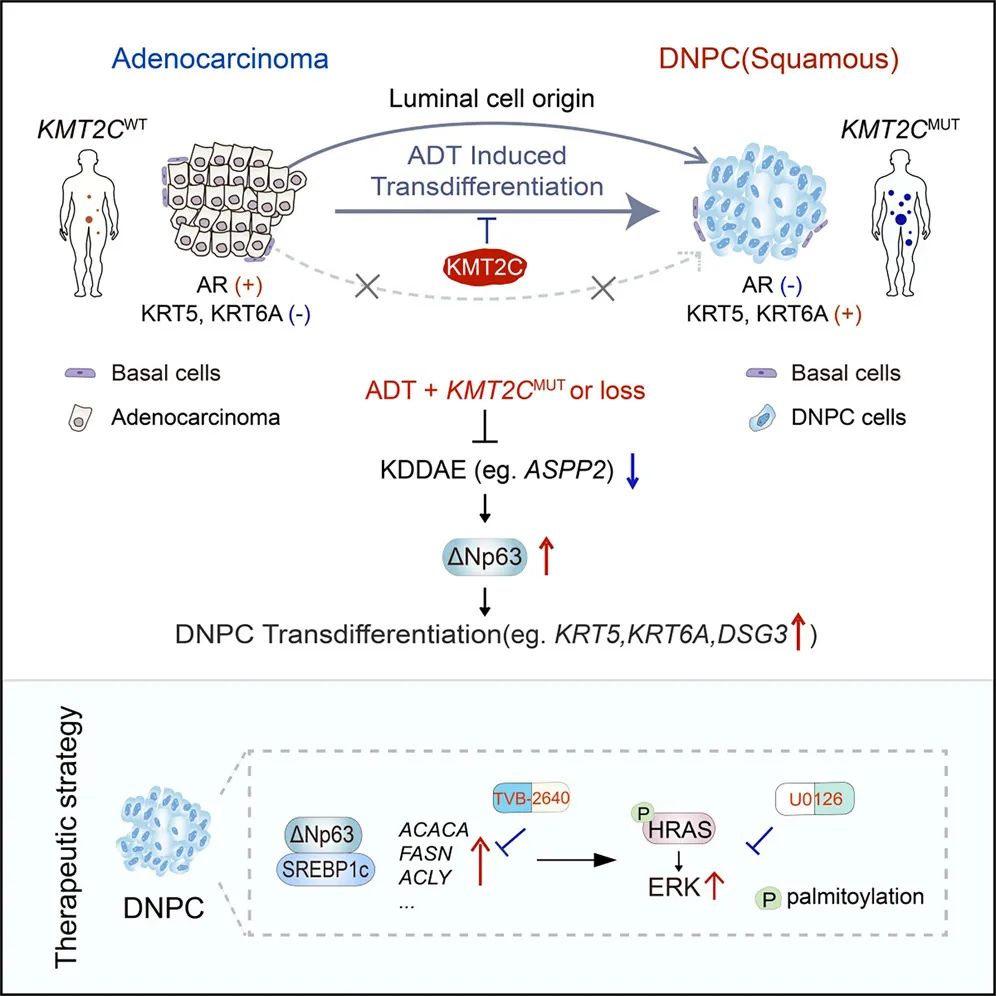
这些发现突显了 KMT2C 是抑制双阴性前列腺癌(DNPC)发展的表观遗传检查点,并表明了靶向脂肪酸合成,具有潜在治疗价值。
中科院上海营养与健康研究所秦骏、安徽医科大学梁朝朝、中国科学院分子细胞科学卓越创新中心袁怀瑞、上海交通大学医学院附属仁济医院董樑等人在 Cell 子刊 Cancer Cell 上发表了题为:KMT2C deficiency drives transdifferentiation of double-negative prostate cancer and confer resistance to AR-targeted therapy 的研究论文。
该研究表明,KMT2C 的缺失促使双阴性前列腺癌(DNPC)的转分化并赋予其对雄激素受体(AR)靶向治疗的耐药性。

在这项最新研究中,研究团队发现,携带 KMT2C 基因突变或缺失的肿瘤在接受雄激素剥夺治疗(ADT)后,极易转变为双阴性前列腺癌(DNPC)。
该研究进一步确定,DNPC 主要源于管腔细胞的转分化,而非基底细胞的转化。抗雄激素治疗促使 KMT2C 与部分受 AR 调控基因的增强子结合,从而维持腺癌细胞谱系。KMT2C 通过增强子-启动子通讯在雄激素受体抑制后维持 ASPP2 的表达,而其失活会降低 ASPP2 水平,从而引发 ΔNp63 依赖性转分化。这种 DNPC 转化通过 ΔNp63 介导的 SREBP1c 转录激活维持脂肪酸(FA)合成,通过 HRAS 棕榈酰化修饰和 MAPK 信号激活为 DNPC 生长提供能量。
该研究的核心发现:
KMT2C 基因突变出现在人类双阴性前列腺癌(DNPC),并与不良预后相关;
Kmt2c 失活驱动 ΔNp63 依赖的向 DNPC 的转变;
DNPC 起源于管腔上皮细胞的转分化,而非基底细胞的转化;
抑制脂肪酸合成以阻断 HRAS 棕榈酰化修饰,可限制 DNPC 生长。
这些发现突显了 KMT2C 是抑制双阴性前列腺癌(DNPC)发展的表观遗传检查点,并表明了靶向脂肪酸合成,具有潜在治疗价值。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


