Cancer Cell:四川大学石虎兵/马学磊团队发现循环肿瘤细胞免疫逃逸新机制
来源:生物世界 2023-01-29 11:47
血小板来源RGS18通过AKT-GSK3β-CREB信号通路驱动CTCs中HLA-E的表达上调。有趣的是,该研究发现CTCs可以内吞血小板,并获得RGS18基因,从而帮助CTCs逃避NK细胞的免疫监视
肿瘤细胞的转移扩散是癌症相关死亡的主要原因。从原发灶肿瘤脱落的循环肿瘤细胞(Circulating tumor cells,CTCs)被认为是肿瘤远端转移的“种子”。阐明肿瘤细胞转移扩散的潜在机制,开发针对肿瘤转移“种子”细胞的新型治疗策略对抑制肿瘤转移具有重要意义。
近年来,随着人们对肿瘤免疫逃逸的认知,免疫检查点阻断疗法已经彻底改变了多种癌症的治疗模式。目前,实体肿瘤原发或转移灶肿瘤微环境中肿瘤细胞与不同类型的免疫细胞之间的免疫检查点分子已经得到了广泛的研究。由于血液循环是肿瘤细胞从原发灶向远端转移的主要途径,研究CTCs与血液中免疫细胞之间的相互作用可能提供一种通过激活宿主免疫系统来阻断转移的策略。然而,目前关于CTCs在血液中如何逃脱宿主免疫监视的机制尚不清楚,也缺乏有效的抑制CTCs转移扩散的治疗方案。
2023年1月26日,四川大学华西医院生物治疗国家重点实验室石虎兵教授团队联合四川大学华西医院马学磊副教授在 Cancer Cell 期刊发表了题为:Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance 的研究论文。
该研究发现了循环肿瘤细胞(CTCs)与自然杀伤(NK)细胞之间新的免疫检查点分子对——HLA-E:CD94-NKG2A,阐明了CTCs逃避宿主免疫监视的新机制,进而提出靶向免疫检查点HLA-E:CD94-NKG2A抑制肿瘤转移的治疗策略。

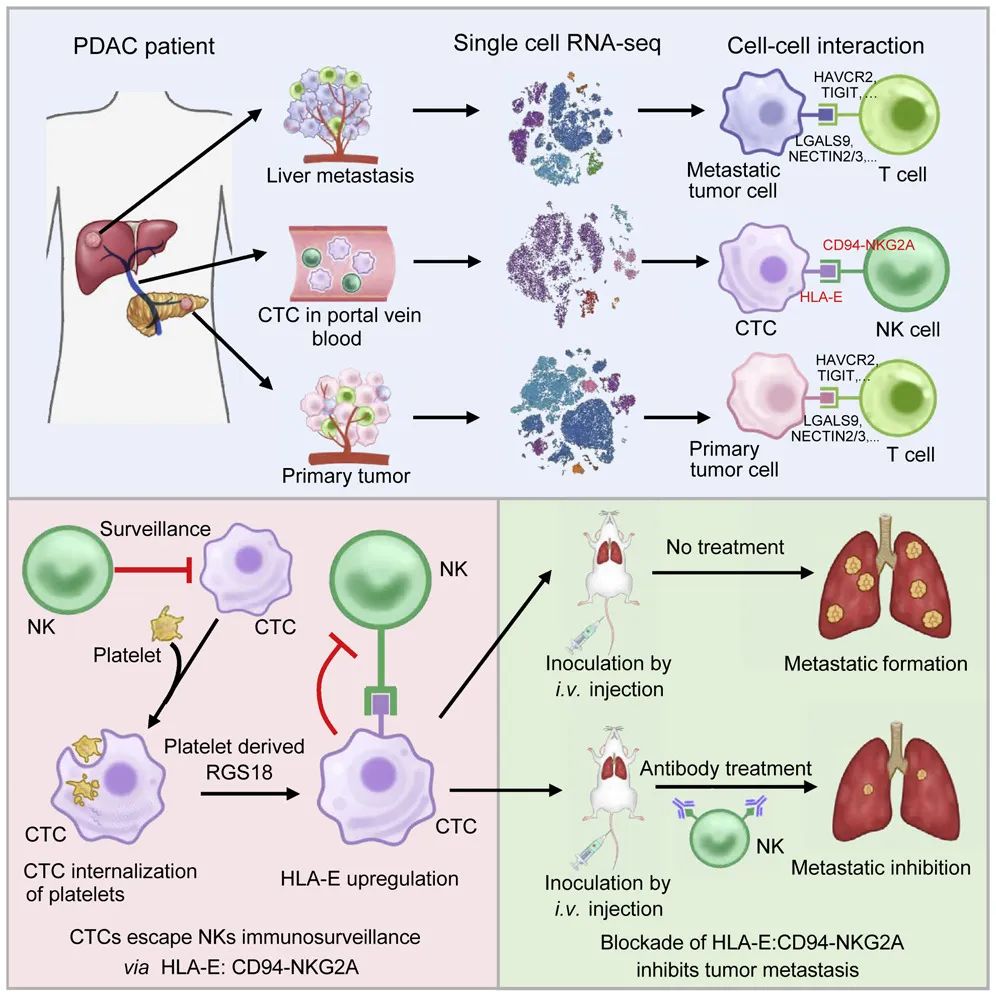
为了研究CTCs的转移机制,研究团队以胰腺导管癌(PDAC)肝转移为模型,利用单细胞转录组测序技术刻画了PDAC原发灶肿瘤、CTCs和肝转移灶肿瘤微环境的转录普特征,基于CellPhoneDB分析了原发灶肿瘤细胞、CTCs和转移灶肿瘤细胞与免疫细胞间的相互作用,鉴定出CTCs与NK细胞间特异性的免疫检查点分子对HLA-E:CD94-NKG2A。
并通过体内外实验,证明了利用anti-NKG2A的阻断抗体或者shHLA-E阻断该免疫检查点分子对的结合可有效的抑制肿瘤转移,表明HLA-E:CD94-NKG2A是CTCs与NK细胞间的一个新型的免疫检查点分子对。
进一步的分子机制研究发现,血小板来源RGS18通过AKT-GSK3β-CREB信号通路驱动CTCs中HLA-E的表达上调。有趣的是,该研究发现CTCs可以内吞血小板,并获得RGS18基因,从而帮助CTCs逃避NK细胞的免疫监视。
这一发现颠覆了以往人们认为血小板黏附在CTC表面保护CTCs的认知,为研究血小板促进肿瘤转移提供了新的思路。
该工作的主要创新点包括:
1)发现血液循环、原发灶和转移灶肿瘤微环境中肿瘤细胞与免疫细胞间的相互作用显著不同。
2)发现CTCs通过免疫检查点分子对HLA-E:CD94-NKG2A逃避宿主免疫监视的新机制。
3)证实了阻断免疫检查点HLA-E:CD94-NKG2A可抑制肿瘤转移,为治疗肿瘤转移提供了新的靶点。
4)发现CTCs通过内吞血小板获得RGS18基因,上调免疫检查点HLA-E的表达,从而逃避NK细胞免疫监视。
四川大学华西医院刘小伟助理研究员、四川大学生物治疗国家重点实验室博士研究生宋金恩、刘馨雨和四川大学华西医院张浩副教授为论文共同第一作者,四川大学生物治疗国家重点实验室石虎兵教授和四川大学华西医院生物治疗科马学磊副教授为通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


