《癌细胞》:上海交大/同济大学/中科院团队首次证实,瘤内真菌可通过髓源性抑制细胞促进肺癌进展
来源:奇点糕 2023-10-16 18:45
研究人员在92名肺腺癌患者队列中证实,聚多曲霉的富集与MDSCs、调节性T细胞和PD-1阳性CD8阳性T细胞的数量增加呈正相关,且聚多曲霉的富集程度越高,患者的预后越差。
近期,上海交通大学公共卫生学院王慧/刘宁宁团队与同济大学张鹏团队,以及中国科学院上海免疫与感染研究所陈昌斌团队联合发表了一篇文章,首次揭示了,瘤内真菌促进肺癌进展的分子机制。
他们利用真菌DNA提取和深度宏基因组测序,在肺腺癌患者中发现了一株能促进肺癌进展的真菌菌株-聚多曲霉(Aspergillus sydowii),并在三种肺癌小鼠模型中发现,聚多曲霉可以通过β-葡聚糖/Dectin-1/CARD9信号通路,促进IL-1β分泌,进一步募集下游的髓源性抑制细胞(MDSCs),增强其抑制CD8阳性T细胞的杀伤能力,最终形成一个免疫抑制的微环境,从而促进肺癌进展。
此外,他们还在人类样本中证实,聚多曲霉在肿瘤内的富集与免疫抑制和肺癌患者预后较差密切相关,这也为以靶向真菌为基础的肺癌个体化治疗提供了新的思路。
研究发表在《癌细胞》上。

论文首页截图
在既往研究中,通过对多种癌症患者组织中的真菌序列进行检测后,人们发现,真菌检出率较高的部位之一是肺组织。
于是,在本研究中,研究人员就把重点放在了肺组织上,利用荧光原位杂交,研究人员发现,与非肿瘤组织相比,肺腺癌肿瘤组织中的真菌富集度明显更高。随后通过深度宏基因组测序,研究人员从肺腺癌肿瘤组织中鉴定出了一株存在明显富集的真菌-聚多曲霉。
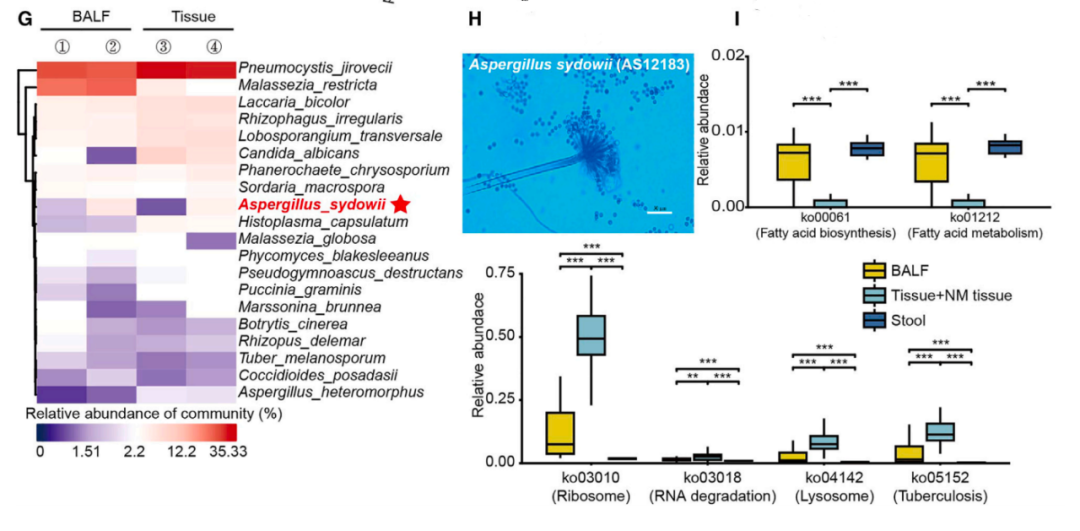
聚多曲霉
通常情况下,人类每天能吸入100-1000个可以到达肺泡的分生孢子,而曲霉菌属又是口腔中最常见的真菌种类,研究人员又分析了肺腺癌患者口腔中聚多曲霉的定植情况,结果发现,约有80%的患者口腔样本中存在聚多曲霉定植,说明,聚多曲霉很可能是一种常见的肺部共生真菌。
接下来,研究人员成功地从7个肺腺癌患者的肿瘤组织中分离、培养出了三株活性真菌,并通过PacBio全基因组测序证实,这些分离出来的真菌为聚多曲霉后,研究人员又比较了聚多曲霉和其他真菌(如烟曲霉和白色念珠菌)在基因组上的差异。
结果发现,尽管聚多曲霉和其他真菌在基因水平上有一些相似,但大部分都是与癌症有关的基因,这也意味着,聚多曲霉可能与肺癌进展有关。
为了进一步弄清楚聚多曲霉与肺癌进展之间的关系,研究人员先是构建了三种肺癌小鼠模型(包括Lewis肺癌小鼠模型[LLC细胞原位注射]、自发性KP小鼠模型[提取KP细胞通过气管注射],以及通过Cre重组酶诱导的自发性KP小鼠模型),随后将聚多曲霉注射到肿瘤内,来观察肿瘤进展情况。
结果在三种肺癌小鼠模型中,研究人员均观察到,聚多曲霉显著加速了肿瘤的进展,具体表现为肿瘤的体积和重量的增加。此外,转录组学分析显示,在肿瘤组织内,出现了与髓系白细胞趋化和迁移,以及IL-1β分泌有关的基因表达上调的现象。
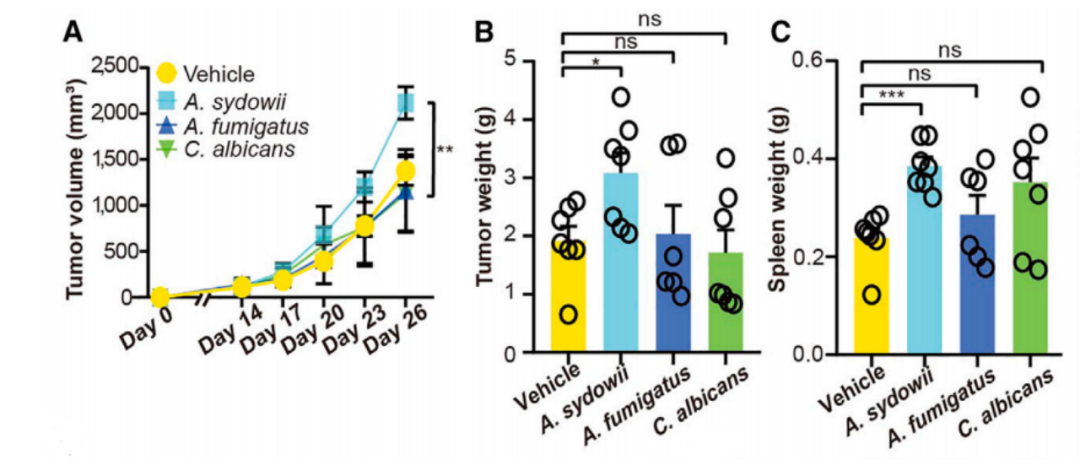
聚多曲霉处理后肿瘤的体积和重量变化情况
流式细胞术分析显示,经聚多曲霉处理后,肿瘤微环境中,与免疫抑制有关的细胞,如MDSCs、调节性T细胞和PD-1阳性CD8阳性T细胞(耗竭的CD8阳性T细胞)的数量明显增加。增加的MDSCs和耗竭的CD8阳性T细胞证实,聚多曲霉处理的确会让肿瘤微环境处于一个免疫抑制状态。
机制上,研究人员发现,聚多曲霉可以通过细胞壁中的β-葡聚糖与其特异性受体Dectin-1结合,诱导宿主细胞CARD9信号通路的表达,促进IL-1β的分泌,并募集下游MDSCs细胞,增强其抑制CD8阳性T细胞活性的能力,进一步促进肿瘤进展,而这一过程主要是靠IL-1β介导的,因为使用IL-1β抑制剂可以实现肿瘤负荷的降低。
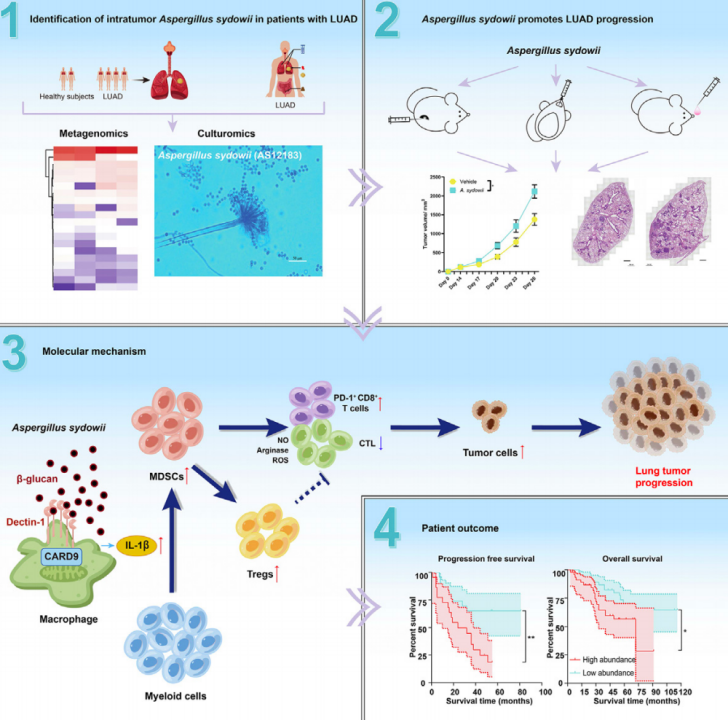
研究机制图
最后,研究人员在92名肺腺癌患者队列中证实,聚多曲霉的富集与MDSCs、调节性T细胞和PD-1阳性CD8阳性T细胞的数量增加呈正相关,且聚多曲霉的富集程度越高,患者的预后越差。
总之,该研究发现,尽管真菌在肿瘤内的富集程度很低,但它仍促进了肺癌的进展,研究也首次揭示了肿瘤内真菌导致肺癌进展的分子机制,不仅支持了将真菌作为临床上潜在的癌症生物标志物这一观点,还为肺癌患者的个体化治疗提供了新的治疗思路。
参考文献:
[1]Liu NN, Yi CX, Wei LQ, Zhou JA, Jiang T, Hu CC, Wang L, Wang YY, Zou Y, Zhao YK, Zhang LL, Nie YT, Zhu YJ, Yi XY, Zeng LB, Li JQ, Huang XT, Ji HB, Kozlakidis Z, Zhong L, Heeschen C, Zheng XQ, Chen C, Zhang P, Wang H. The intratumor mycobiome promotes lung cancer progression via myeloid-derived suppressor cells. Cancer Cell. 2023 Sep 19:S1535-6108(23)00288-X.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


