GUT:阿尔茨海默病毒蛋白可由脑入肠!科学家发现,tau蛋白可从大脑传播至肠道,破坏肠道微生态
来源:奇点糕 2025-09-27 09:57
研究人员在AD小鼠和结肠芯片器官中均验证了,tau蛋白可以从海马传播至迷走神经运动背核(DMV),再传播至结肠。
越来越多的证据表明,肠道功能紊乱以及脑-肠轴与阿尔茨海默病(AD)的发病机制密切相关,这在人类患者和动物模型中均有体现。迷走神经是脑-肠轴中的关键组成部分,在大脑与肠道之间起着双向通信的作用。好几年前就有研究发现,肠道炎症可诱导肠道局部产生AD病理蛋白,经由迷走神经播散至脑部,引起AD相关神经病理改变及认知障碍。
但既然是双向通信,那么大脑到肠道,是否也有这种病理蛋白的传播,由此对肠道功能产生影响呢?
在最近的《胃肠病学》杂志上,韩国首尔国立大学的研究团队发表了最新研究成果,他们在AD小鼠和结肠芯片器官中均验证了,tau蛋白可以从海马传播至迷走神经运动背核(DMV),再传播至结肠。
他们开发的结肠芯片器官也是首个成功模拟脑至肠神经通路的体外系统。在这一模型中,tau蛋白通过迷走神经运动神经元传播至肠神经元,最终导致结肠上皮屏障完整性受损。这表明,AD相关肠道症状,如肠道炎症、屏障不稳定和菌群失调,可能与被病理性tau蛋白“劫持”的迷走神经传出信号密切相关。


研究人员选择了ADLPAPT转基因小鼠模型,表达人类AD相关APP、PSEN1和MAPT突变基因,会随时间先后积累β淀粉样蛋白(Aβ)和tau蛋白病理。
他们检查7月龄小鼠的脑干,发现海马中有明显的神经原纤维缠结病理,迷走神经输出至胃肠道的主要区域DMV的神经元也有明显的tau聚集,并且是高度磷酸化的tau,但是没有Aβ沉积,这与在AD患者脑干中观察到的现象一致。
小鼠结肠组织与脑干的情况类似,也检测到显著的不溶性和可溶性tau蛋白,但几乎检测不到APP蛋白。进一步的分析显示,结肠中的tau主要定位于肌间神经丛和黏膜下神经丛。
对不同月龄小鼠的持续跟踪还发现,tau磷酸化水平会随年龄逐渐增加,体现了tau病理的动态进展。
通过免疫染色和荧光成像技术,研究人员确定,这些tau是从海马沿着神经轴突传播至DMV神经元,然后继续经由轴突传播至结肠神经丛,这种传播在野生型小鼠中没有观察到。
为了深入探究致病性tau沿迷走神经的传播机制及其生物学意义,研究人员开发了一种新型体外结肠芯片模型。该模型通过集成微流控装置,实现了对迷走神经运动神经元(VMN)向结肠传播tau过程的精准调控与实时观测。
他们首先使用优化方案,从人诱导性多能干细胞(iPSC)分化出具有轴突束的VMN,可以观察到tau在VMN中沿着轴突方向移动,并且是以主动运输的方式,而非被动扩散。然后,他们构建了一个结肠芯片,使用iPSC分别分化出肠神经元和上皮细胞,三种细胞被分别种植在微流控芯片的不同区域,形成一个结构化的三维模型。
VMN的轴突延伸至肠神经元区域,形成突触连接。肠神经元的神经末梢进一步延伸至上皮细胞区域,模拟肠道神经对上皮细胞的支配。芯片中包含微通道和液体流动系统,可以模拟肠道的物理环境和营养交换。
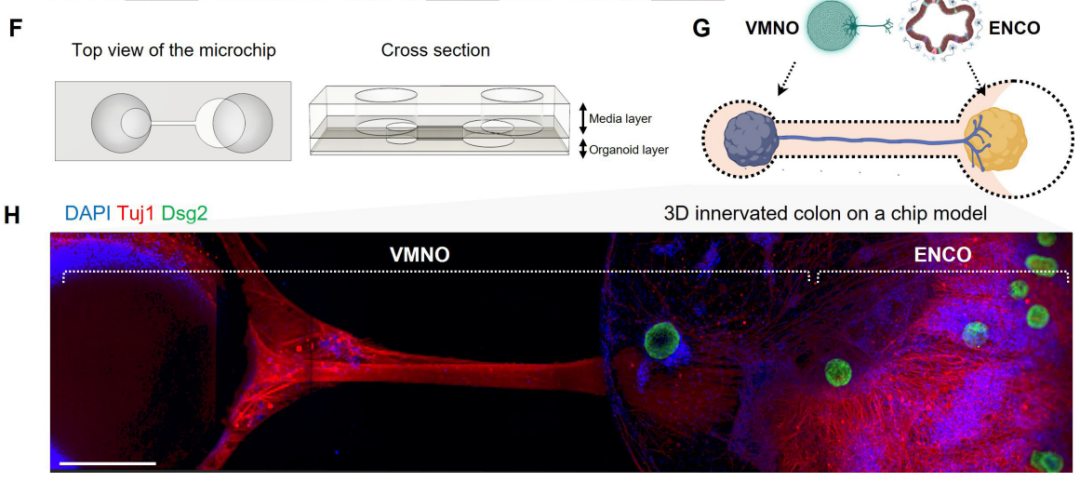
结肠芯片器官的构建和染色显示出的VMN对结肠类器官的神经支配
研究人员将荧光标记的tau预制原纤维(PFF)加入到芯片的VMN中,观察到tau PFF沿轴突运输至突触末端,成功传播至肠神经元,并在其中聚集,随后导致上皮细胞紧密连接蛋白表达显著下降,屏障功能受损,结肠芯片的通透性增加。
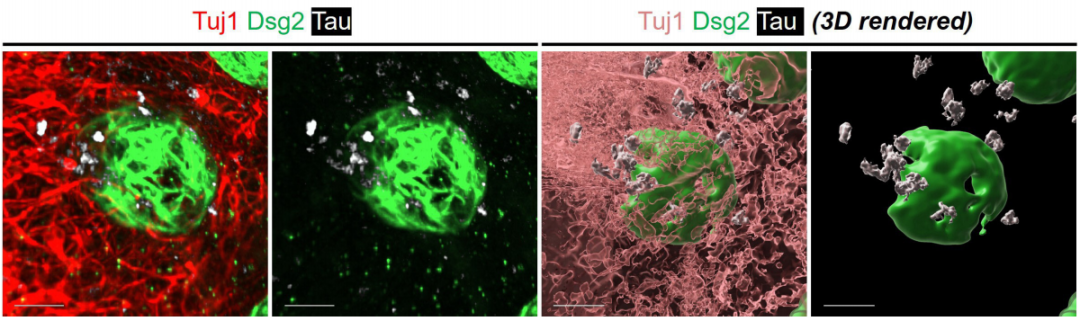
肠神经元内的tau成像和3D渲染
基于这些现象,研究人员指出,这表明了大脑通过VMN将致病性tau从大脑“运输”到肠神经元中,积累的tau潜在性地造成了AD相关结肠上皮稳定性破坏。
综上所述,这项研究系统地揭示了病理性tau在脑-肠轴中的传播路径及其功能性影响,这拓展了我们将AD作为一种系统化疾病的认知,也提示迷走神经作为tau传播的通道,可能能够成为一个重要的干预靶点。另外,研究人员开发的结肠芯片在未来也能够帮助进行病理蛋白传播机制和阻断药物筛选的研究,以及评估药物对肠道屏障的保护作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


