AAV+睡美人+mRNA:陈斯迪/叶露鹏实现细胞治疗产品的高效制备
来源:生物世界 2023-07-17 11:00
该研究建立了一种集合了腺相关病毒(AAV)、睡美人转座子和mRNA的优点的细胞遗传改造平台——MAJESTIC,MAJESTIC可用于治疗性免疫细胞的高效制备
细胞免疫疗法涉及活细胞给药,基因修饰的免疫细胞可以增殖、适应环境、与周围细胞建立联系,进而引发直接或间接针对肿瘤细胞进行破坏的动态反应。过继细胞转移是细胞免疫治疗的一种,它涉及直接靶向患者肿瘤细胞的细胞转移,例如CAR-T细胞疗法,在血液类癌症中取得了令人瞩目的治疗效果。目前已有6款CAR-T细胞疗法获得美国FDA批准上市。
为了应对不同肿瘤和肿瘤环境所带来的许多挑战,除了CAR-T细胞之外,还诞生了多种其他基于细胞的免疫治疗方法,例如肿瘤浸润淋巴细胞(TIL)、T细胞受体工程T细胞(TCR-T)、CAR-NK细胞、CAR-巨噬细胞,以及诱导多能干细胞(iPSC)驱动的治疗性免疫细胞疗法。
目前,临床试验中使用的大多数CAR-T细胞是使用γ-逆转录病毒或慢病毒进行基因递送产生的。然而,这些病毒载体存在一些限制,例如,递送进细胞的转基因表达可能被沉默或抑制。此外,γ-逆转录病毒和慢性毒在宿主细胞基因组的整合可能具有致癌风险。腺相关病毒(AAV)被认为是一种更安全的基因治疗载体,然而,AAV并不是理想的CAR递送载体,因为它是非整合的,因此在T细胞扩增过程中,CAR的表达会被迅速稀释。
耶鲁大学医学院陈斯迪团队(第一作者叶露鹏现为南京大学现代生物研究院研究员)在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:AAV-mediated delivery of a Sleeping Beauty transposon and an mRNA-encoded transposase for the engineering of therapeutic immune cells 的研究论文。
该研究建立了一种集合了腺相关病毒(AAV)、睡美人转座子和mRNA的优点的细胞遗传改造平台——MAJESTIC,MAJESTIC可用于治疗性免疫细胞的高效制备,为临床细胞治疗(例如CAR-T、CAR-NK)提供了全新的技术支撑。


叶露鹏(左),陈斯迪(右)
病毒递送载体存在着一些局限,然而,目前所有的非病毒细胞治疗方法也有其局限性。电穿孔递送mRNA是另一种CAR-T细胞生成策略,但由于mRNA的不稳定性,CAR表达的持续时间很短。
PiggyBac和睡美人(Sleeping Beauty)等转座子系统可用于直接将DNA序列整合到基因组中,具有相当于慢病毒和逆转录病毒的优势。转座子系统也因其非致病性起源而受到关注。但目前用于治疗性细胞生成的转座子/转座酶方法主要依赖于DNA电穿孔或质粒、微环DNA的转染,但其递送效率在不同的研究中有所不同,并且细胞毒性通常很高。此外,转座酶反复动员转座子可能导致插入性突变或局部染色体重排的持续风险。
截至目前,所有的细胞治疗工程方法,无论是基于病毒还是非病毒递送方法,都存在一些重要的局限性。在这项研究中,研究团队希望开发出一种非CRISPR基因递送方法,能够产生稳定整合的治疗性免疫细胞,且具有以下特点:1)在不依赖逆转录病毒或慢病毒的情况下实现高效的基因组整合;2)理论上限制转座子动员程度;3)与现有方法相比,生成的免疫细胞具有更高的生存能力;4)无需基因编辑。
在这项研究中,研究团队将腺相关病毒(AAV)、睡美人转座子和mRNA的优点结合,开发了一种细胞遗传改造平台——MAJESTIC(mRNA AAV–SB joint engineering of stable therapeutic immune cells)。
在MAJESTIC中,mRNA组件编码一个转座酶,该转座酶介导睡美人转座子的基因组整合,睡美人转座子携带目的基因(例如表达CAR),通过AAV进行递送。
质粒DNA比mRNA更稳定,每次复制可产生多个mRNA拷贝,将转座酶作为mRNA递送,可以限制其再活化和可能带来的染色体重排。
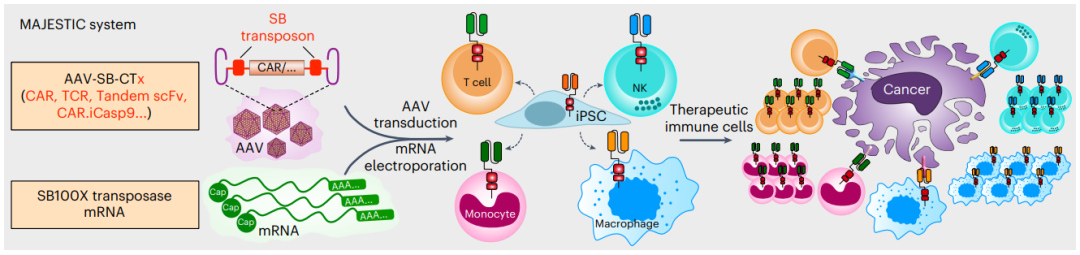
研究团队将这一基因递送系统命名为MAJESTIC(mRNA AAV–SB joint engineering of stable therapeutic immune cells),与慢病毒载体和通过电穿孔递送的转座子DNA或小环形DNA相比,MAJESTIC系统能够提供更长时间的转基因表达,以及更高的转基因表达水平,治疗性工程化免疫细胞产量和细胞活力。
MAJESTIC系统可以将嵌合抗原受体(CAR)递送到T细胞,用来构建具有强大的体内抗肿瘤效果的CAR-T细胞。此外,该系统还可以将双特异性CAR、杀伤开关CAR和合成T细胞受体地送到自然杀伤细胞、骨髓细胞和诱导多能干细胞(iPSC)中。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


