Nature:免疫系统的提前布局,T细胞如何为慢性感染“未雨绸缪”?
来源:生物探索 2025-01-11 13:35
该研究通过多种实验技术,包括单细胞RNA测序(scRNA-seq)、流式细胞术和表观遗传分析,揭示了急性感染中形成的T细胞群体的异质性。
在对抗慢性感染和肿瘤的斗争中,T细胞衰竭(T cell exhaustion)是一个备受关注的领域。T细胞的衰竭状态使它们在面对长期的抗原暴露时功能减退,表现为效应功能削弱和细胞毒性因子的减少。这种现象不仅阻碍了免疫系统清除慢性病毒感染和肿瘤细胞的能力,还为新型免疫疗法的开发带来了重大挑战。然而,衰竭T细胞的前体是否只能在慢性感染中形成?或者,它们是否也能在急性感染的早期阶段被预先“部署”?这些问题的答案不仅挑战了传统的免疫学观点,也为未来的免疫治疗策略提供了新的启示。
1月8日Nature的研究报道“Precursors of exhausted T cells are preemptively formed in acute infection”,通过多种实验技术,包括单细胞RNA测序(scRNA-seq)、流式细胞术和表观遗传分析,揭示了急性感染中形成的T细胞群体的异质性。结果发现,在急性感染的早期阶段,部分T细胞已显示出类似于慢性感染中衰竭前体细胞(Tpex, precursors of exhausted T cells)的特征。这些细胞不仅表达衰竭相关标志物(如PD-1和TOX),还呈现出独特的转录组和表观遗传特征。这一发现颠覆了传统观念,表明即使在急性感染中,T细胞衰竭的“种子”也已被提前播下。
此外,研究还揭示了T细胞受体(TCR)信号强度和PD-1信号在调控这些衰竭前体细胞形成中的关键作用。这不仅帮助我们理解衰竭T细胞的形成机制,还为增强免疫应答或抑制过度炎症的治疗策略提供了潜在的干预靶点。
该研究不仅揭示了免疫系统在急性感染期间的复杂性,还为免疫治疗提供了新的方向——通过调控衰竭前体细胞,或许可以在慢性疾病和肿瘤治疗中实现更加精准和高效的干预。

T细胞衰竭:免疫系统的“双刃剑”
在免疫系统中,T细胞是抵御病毒感染和肿瘤的核心武器。然而,当T细胞在面对持续抗原刺激时,其功能会逐渐减弱,进入一种被称为“衰竭”(exhaustion)的状态。研究表明,这种现象虽然常见于慢性病毒感染和肿瘤中,但其形成机制和作用却比我们想象的更加复杂。
衰竭T细胞主要表现为功能性削弱,包括细胞因子分泌能力的下降和杀伤目标细胞效率的降低。它们通常伴随高表达的抑制性受体(如PD-1、LAG-3)和特定的转录因子(如TOX、EOMES)的激活。此外,这些细胞还具有稳定的表观遗传标记,使其“衰竭”状态即使在抗原消失后也难以逆转。这种状态看似是免疫系统的一个“失败”标志,但实际上它承担了双重角色。
一方面,衰竭T细胞是免疫系统对抗长期抗原暴露的一种保护性机制。它们的功能性削弱避免了免疫系统的过度活化,从而减少组织损伤和免疫病理的风险。另一方面,这种状态也削弱了免疫系统清除病毒或肿瘤的能力。特别是在慢性肝炎病毒感染或某些肿瘤中,衰竭T细胞的低效能成为免疫治疗的重大障碍。
T细胞衰竭的存在体现了免疫系统的复杂平衡:它既是对持久抗原的防御性妥协,也是制约免疫治疗成功的一大难题。
传统认知的挑战:衰竭前体细胞的“意外”发现
长期以来,衰竭T细胞(exhausted T cells)的形成被认为是慢性感染或肿瘤特有的现象。这些疾病通常伴随着持续的抗原暴露和炎症环境,这种复杂的免疫刺激条件被视为衰竭T细胞生成的必要因素。传统观念认为,在急性感染中,由于病原体通常被迅速清除,T细胞大多形成记忆细胞,而非衰竭细胞。然而,这一理论在该研究中被颠覆。
该研究通过单细胞RNA测序(scRNA-seq)和表观遗传分析,首次在急性感染的早期阶段发现了衰竭前体细胞(Tpex, precursors of exhausted T cells)。这些细胞表现出与慢性感染中Tpex类似的分子特征,例如高表达PD-1和TOX,同时具备独特的转录组和表观遗传特征。这一发现表明,Tpex并非慢性感染的“专属产品”,而是在急性感染中就已“预设”。
进一步分析显示,在急性感染的早期阶段,Tpex与传统记忆前体细胞(Tmpc, memory precursor T cells)共存于异质性T细胞群体中。这些Tpex在急性感染中最初数量相当可观,但随着感染被免疫系统清除,它们的数量逐渐减少,但并未完全消失。这种现象表明,无论感染结果如何,衰竭前体细胞都被“预先生成”,以备感染可能进入慢性阶段。
这一突破性研究不仅挑战了传统观点,还揭示了免疫系统的“未雨绸缪”机制:通过在急性感染中提前生成Tpex,机体为可能的慢性感染做好准备。这种适应性策略可能是进化过程中的一项重要功能,为我们提供了重新认识T细胞衰竭动态过程的全新视角。
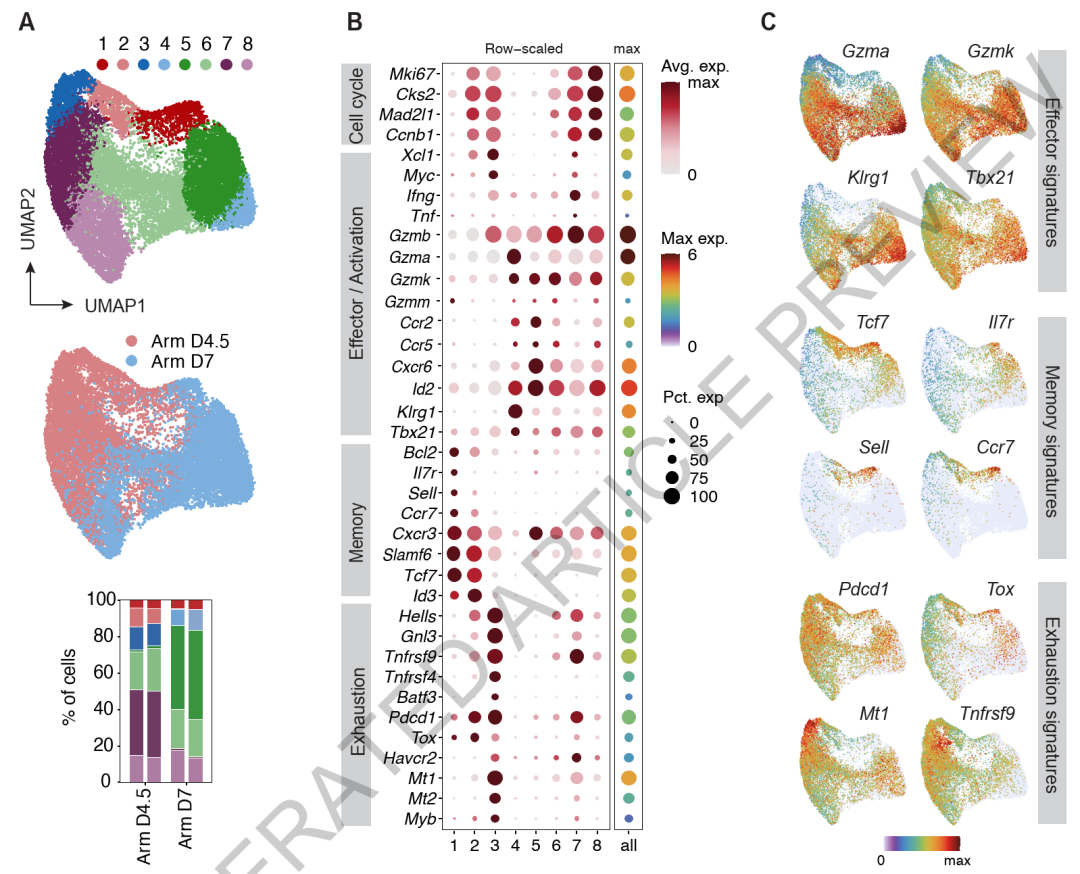
急性LCMV特异性T细胞群体的转录特性与衰竭T细胞的相似性(Credit: Nature)
UMAP聚类分析(A):
研究基于已发表的数据集,分析了转移LCMV特异性TCR转基因P14 T细胞的转录组特性,这些细胞在急性LCMV Armstrong感染的小鼠模型中,于感染后4.5天和7天被分离并检测。上图的UMAP投影识别出8个细胞亚群,并通过Louvain算法进行分类,展示了这些细胞的转录组异质性。中图显示了4.5天和7天两个时间点上,细胞群在各个亚群中的分布。结果显示,这些亚群在时间上的动态分布存在明显差异,提示感染进程对T细胞命运的影响。下方的柱状图则进一步量化了各个亚群在不同时间点的相对数量比例,揭示了某些亚群(如与记忆相关的细胞群)在后期显著增加,而其他亚群(如效应细胞群)可能逐渐减少。
簇特征的基因表达(B):
使用基因特征点图(Signature dot plot)分析各个亚群中不同标志基因的表达情况。颜色编码表示基因的平均表达水平,圆圈大小则表示亚群内表达该基因的细胞比例。分析结果显示,与衰竭相关的标志基因(如TOX、PD-1)在部分亚群中显著表达,而其他亚群则呈现记忆标志基因(如IL7R)或效应基因(如GZMB、IFNG)的高表达。这一结果说明,即使在急性感染中,也存在转录特性与慢性感染中衰竭T细胞相似的细胞群。
特定基因表达的特征分布(C):
使用特征图(Feature plots)展示了特定标志基因(如效应基因GZMB、记忆基因IL7R、衰竭基因TOX和PD-1)的空间分布及表达水平。结果显示,不同标志基因在UMAP投影中的分布模式清晰,进一步支持了T细胞亚群在急性感染中具有显著的功能异质性。例如,效应细胞群以高表达GZMB为特征,而某些与衰竭相关的标志基因则在另一些群体中呈现出明显表达。
从分子到细胞:Tpex的独特特征
衰竭前体细胞(Tpex)是一个在急性和慢性感染中均被发现的特殊T细胞群体,其独特的分子和功能特性将其与传统记忆前体细胞(Tmpc)区分开来。通过单细胞RNA测序和表观遗传分析,研究人员揭示了Tpex与Tmpc在转录组和功能层面的差异,并为Tpex的生物学角色提供了全新视角。
在转录组层面,Tpex表现出高表达PD-1和TOX等与T细胞衰竭相关的基因,同时具有特定的转录因子,如NR4A1和IKZF2,这些基因的表达模式更接近于慢性感染中的衰竭T细胞。而相比之下,Tmpc更倾向于表达IL7R和SELL等与长期存活和增殖相关的记忆细胞标志物。此外,Tpex在表观遗传上也显示出独特的“衰竭印记”,例如在TOX和PD-1基因区域的染色质开放程度显著高于Tmpc。这种表观遗传特性为Tpex提供了稳定的细胞身份,即使在环境条件改变后,其特性依然可以部分保留。
功能上,Tpex与Tmpc的分化潜力和效应能力也有显著不同。Tpex更倾向于分化为衰竭终末效应细胞,而Tmpc则具有更高的能力分化为功能完整的效应T细胞或记忆T细胞。实验数据显示,Tpex在感染早期对IFNγ和TNF等关键细胞因子的分泌能力明显低于Tmpc。这表明,Tpex在功能上已展现出向衰竭方向发展的趋势。
尽管Tpex与Tmpc共享部分分子特征(如Tcf7表达),它们却在命运选择上展现出分化路径的明显分歧。这种异同不仅反映了T细胞群体内部的高度异质性,也进一步揭示了Tpex在慢性和急性感染中的独特角色。
TCR信号与PD-1调控:Tpex生成的关键因素
衰竭前体细胞(Tpex)的生成是一个高度复杂且受到多重信号调控的过程,其中T细胞受体(TCR)信号强度和抑制性受体PD-1的作用尤为关键。研究显示,这两种信号在调控Tpex形成中相互交织,塑造了T细胞在急性感染中的命运。
实验结果表明,强TCR信号是Tpex形成的主要驱动力。在急性感染中,高亲和力的抗原刺激能够显著增加Tpex的比例。例如,当OT-1转基因T细胞暴露于高亲和力的N4肽(SIINFEKL)时,其TOX的表达显著高于暴露于低亲和力V4肽(SIIVFEKL)时。这表明,强TCR信号通过驱动特定转录因子(如TOX和NR4A1)的表达,促使T细胞向衰竭方向分化。这种机制在慢性感染中同样存在,但在急性感染中的发现表明TCR信号强度是Tpex生成的普适性关键因素。
然而,TCR信号的强度并非无限制地推动Tpex的生成。PD-1信号在这一过程中扮演了“刹车”的角色。PD-1通过与其配体的结合,抑制T细胞的活化信号,从而限制Tpex的形成。研究发现,当缺乏PD-1的T细胞在感染中接受强TCR信号时,其TOX表达水平显著升高,Tpex比例也明显增加。这一现象表明,PD-1信号通过抑制TCR驱动的转录程序,限制了Tpex的生成,同时可能在急性感染中保护免疫系统免受过度活化的损伤。
强TCR信号和PD-1信号之间的动态平衡不仅决定了Tpex的生成数量,还影响了其功能特性。这一机制揭示了免疫系统对抗感染时的精细调控能力,也为未来通过调控这两种信号开发新型免疫疗法提供了理论依据。
急性感染与慢性感染:Tpex的命运之谜
衰竭前体细胞(Tpex)在急性和慢性感染中的命运既有相似之处,也展现出显著的差异。通过对不同感染模型的深入研究,研究人员得以揭示Tpex的形成、维持及功能如何随感染类型而变化,并初步解开其复杂的命运之谜。
在急性感染中,Tpex的生成具有明显的早期特征。研究表明,感染后4-5天内,这些细胞以高频率出现,数量一度接近传统记忆前体细胞(Tmpc)。然而,随着感染的清除,Tpex数量逐渐减少,许多细胞被功能性记忆T细胞所取代,但部分Tpex仍能长期存留。与之相比,在慢性感染中,由于抗原的持续存在,Tpex能够持续生成并保持较高的比例,为衰竭终末效应T细胞提供长期支持。这种稳定性使得Tpex成为慢性感染中维持免疫应答的重要“储备库”。
功能上,急性感染中的Tpex呈现出高度的多样性和命运可塑性。单细胞RNA测序显示,这些细胞既具备向记忆细胞分化的潜能,也表现出部分衰竭相关特征,如高表达TOX和PD-1。在慢性感染中,Tpex则更倾向于向终末衰竭T细胞分化,其功能性显著受限。这一差异反映了抗原持续性对Tpex命运选择的深远影响。
此外,表观遗传分析揭示了Tpex在不同感染环境中的独特适应性。在急性感染中,Tpex的表观遗传状态较为多样,既包含与记忆细胞相似的特征,也展现出慢性感染Tpex的衰竭印记。这种异质性为Tpex在急性感染中的灵活响应提供了可能性,而慢性感染中的Tpex则通过稳定的衰竭标记巩固其身份。
综合来看,急性感染中的Tpex为免疫系统提供了灵活应对的潜能,而慢性感染中的Tpex则成为维持免疫平衡的关键细胞群体。
表观遗传印记:Tpex的“身份标签”
衰竭前体细胞(Tpex)的独特之处,不仅体现在其转录组和功能特性上,还深深根植于其表观遗传特征。这些“身份标签”不仅定义了Tpex的细胞命运,也为我们理解其在急性与慢性感染中的稳定性提供了重要线索。
研究发现,Tpex在表观遗传层面具有显著的衰竭标记,例如在TOX、PD-1(Pdcd1)等关键基因位点显示出较高的染色质开放程度。这些区域的开放性与衰竭T细胞的功能相关基因一致,表明Tpex在分化过程中已被“预先设定”为向衰竭方向发展的潜在路径。与传统记忆前体细胞(Tmpc)相比,Tpex在表观遗传上更接近慢性疾病环境中的终末衰竭T细胞。
进一步分析表明,这些表观遗传特征在急性和慢性感染中的表现既有共性也有差异。在急性感染中,Tpex的表观遗传状态相对多样化,其开放的染色质区域既包括与记忆相关的基因,也包含衰竭相关基因的标记。这种多样性赋予Tpex较大的命运可塑性,使其既能分化为功能性记忆细胞,又可能发展为终末衰竭T细胞。相比之下,在慢性感染中,由于抗原的持续存在,Tpex的表观遗传特征逐渐稳定,其衰竭印记进一步强化,成为维持慢性炎症环境中免疫平衡的重要细胞群。
通过对急性和慢性感染环境中的表观遗传数据进行比较,研究人员发现,Tpex在两种环境中具有高度相似的表观遗传印记,尤其是在关键转录因子结合位点(如FOS::JUN)上的信号。这表明,无论感染类型如何,Tpex的基础表观遗传特性是稳定的,但其具体功能表现可能因感染环境而有所调整。
这种表观遗传的稳定性赋予Tpex长远的适应能力,同时也为其在免疫治疗中的应用提供了可能性。
可塑性与稳定性:Tpex的未来
Tpex的可塑性与稳定性为其在慢性疾病和肿瘤中的长期作用奠定了基础。作为衰竭T细胞的“源头”,Tpex在维持免疫应答和调控免疫平衡中扮演了关键角色,其分化潜能和适应能力揭示了未来免疫治疗的巨大潜力。
研究表明,Tpex具有独特的分化路径,其一部分可以转化为终末衰竭T细胞,这些细胞通常功能受限,但在持续的抗原压力下维持对病原体或肿瘤的免疫监视。该研究显示,在慢性感染或肿瘤微环境中,Tpex的维持依赖于其干细胞样特性,包括高表达Tcf7和Bcl6等关键基因。这些基因赋予Tpex强大的自我更新能力,使其在长期抗原暴露中成为一种重要的免疫资源。
与此同时,Tpex的可塑性使其在特定环境下能够恢复部分功能。例如,在抗PD-1免疫检查点抑制剂治疗下,Tpex能够迅速扩增并产生功能性效应细胞,从而增强免疫系统的抗肿瘤能力。这一特性使得Tpex成为抗PD-1治疗的主要目标之一,其数量和状态与治疗效果密切相关。
然而,Tpex的稳定性也对其长期作用产生重要影响。研究显示,Tpex的表观遗传特性为其提供了一定的功能保真性,使其即使在动态变化的微环境中仍能维持核心特征。这种稳定性使得Tpex能够适应慢性疾病和肿瘤中的复杂环境,但也可能限制其分化潜能的完全释放。
未来,如何精准调控Tpex的可塑性与稳定性以优化免疫治疗效果,将成为一个重要的研究方向。例如,通过调控Tpex的关键分子途径,或许可以增强其分化为功能性效应细胞的能力,或稳定其干细胞样特性以维持长期免疫应答。
从Tpex的发现到其在治疗中的应用,免疫学研究正在步入一个以精准干预为核心的新纪元。通过深入探索这一细胞群体,我们或许能够将免疫治疗的潜力发挥到极致,为慢性疾病和肿瘤患者带来更多希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


