Nature Medicine | 重返有声世界:双侧AAV1-hOTOF治疗常染色体隐性耳聋9型初见成效
来源:生物探索 2024-06-10 09:57
此外,该研究还证明了AAV1-hOTOF基因治疗的安全性。在所有患者中,未出现严重不良事件或剂量限制毒性,这为未来进一步的临床研究奠定了基础。
遗传性听力障碍的基因治疗是一种充满前景的治疗方法。6月5日 Nature Medicine报道的研究“Bilateral gene therapy in children with autosomal recessive deafness 9: single-arm trial results”显示,单臂的腺相关病毒1型(AAV1)携带人类OTOF基因的基因治疗对患有常染色体隐性耳聋9型(DFNB9)的患者是安全的,并且在功能上有一定的改善效果。随后,研究方案得到了修订和批准,允许双臂基因治疗的实施。
该研究的主要终点是6周内的剂量限制毒性,次要终点包括安全性(不良事件)和有效性(听觉功能和言语感知)。在治疗过程中,没有发生剂量限制毒性或严重不良事件,总共发生了36例不良事件,最常见的是淋巴细胞计数增加(36例中的6例)和胆固醇水平增加(36例中的6例)。所有患者的双侧听力均得到了恢复。
基线时,所有患者右耳和左耳的听觉脑干反应(ABR)阈值均超过95 dB,而在治疗26周后,患者1的右耳和左耳的ABR阈值恢复到58 dB,患者2的右耳和左耳分别恢复到75 dB和85 dB,患者3的右耳和左耳分别恢复到55 dB和50 dB。在治疗13周后,患者4的右耳和左耳的ABR阈值分别恢复到75 dB和78 dB,患者5的右耳和左耳的ABR阈值均恢复到63 dB。
这些结果初步表明,AAV基因治疗在遗传性耳聋的安全性和有效性方面具有潜力。这项试验仍在进行中,需要更长时间的随访来确认这些安全性和有效性发现。根据世界卫生组织的数据,全球超过5%的人口,即4.3亿人,患有使其丧失功能的听力障碍,其中包括3400万儿童。约有2600万人患有先天性听力损失,其中60%归因于遗传因素。OTOF基因的致病性突变导致了OTOF蛋白的缺乏或功能失调,从而引发常染色体隐性耳聋9型(DFNB9)。DFNB9的特征是先天性或语言前期的严重到完全的双侧听力损失,占遗传性耳聋的2-8%。
通过双AAV载体携带人类OTOF基因的AAV1-hOTOF在Otof−/−小鼠和非人灵长类动物中已被证明是有效且安全的。目前,试验已显示,基因治疗在DFNB9儿童患者中是安全和有效的。然而,与单侧听力相比,双侧听力的恢复可能会为患者带来更大的利益,包括更好的言语感知和声音源定位能力。因此,对于患有双侧耳聋的患者来说,恢复双侧听力是至关重要的,以最大化听力恢复的好处。

听力障碍是全球常见的健康问题之一。据世界卫生组织(WHO)统计,全球约有4.3亿人患有中度或以上程度的听力损失,其中包括3400万儿童。在这些听力损失病例中,约有2600万人是先天性的,其中60%归因于遗传因素。常染色体隐性耳聋9型(DFNB9)是一种由于OTOF基因突变导致的先天性听力障碍,其特征是先天性或语言前期的严重至完全的双侧听力损失。
OTOF基因编码的Otoferlin蛋白在听觉信号传导中起着关键作用。OTOF基因的突变会导致Otoferlin蛋白的功能缺失或异常,从而引起DFNB9。这种疾病通常表现为出生时或语言发育前期的严重听力损失,患者几乎完全丧失听觉功能。近年来,基因治疗作为一种有前景的治疗方法,受到了广泛关注。
该研究采用腺相关病毒1型(AAV1)携带人类OTOF基因的基因治疗方案。AAV1-hOTOF基因载体通过耳蜗窗口(round window)注射到患者的双侧耳蜗中,旨在恢复听觉功能。研究共纳入五名患有DFNB9的儿童患者,平均年龄为2.8岁。研究的主要终点是评估治疗6周内的剂量限制毒性,次要终点包括安全性(不良事件)和有效性(听觉功能和言语感知)。
在研究过程中,所有患者均未出现剂量限制毒性或严重不良事件。共记录到36例不良事件,其中最常见的是淋巴细胞计数增加(6例)和胆固醇水平增加(6例),这些不良事件均为轻度至中度(1-2级)。
听觉功能的恢复:所有患者的双侧听力均得到不同程度的恢复。基线时,所有患者的右耳和左耳的听觉脑干反应(ABR)阈值均超过95 dB。在治疗26周后,患者1的右耳和左耳的ABR阈值恢复到58 dB,患者2的右耳和左耳分别恢复到75 dB和85 dB,患者3的右耳和左耳分别恢复到55 dB和50 dB。在治疗13周后,患者4的右耳和左耳的ABR阈值分别恢复到75 dB和78 dB,患者5的右耳和左耳的ABR阈值均恢复到63 dB。
在听觉稳态反应(ASSR)测试中,患者的听力阈值也显示出显著改善。例如,患者1的右耳和左耳的ASSR阈值分别从基线的103 dB和103 dB改善到治疗26周后的53 dB和58 dB。患者2的右耳和左耳的ASSR阈值分别从基线的88 dB和83 dB改善到治疗26周后的60 dB和60 dB。患者3的右耳和左耳的ASSR阈值分别从基线的100 dB和100 dB改善到治疗26周后的55 dB和50 dB。患者4的右耳和左耳的ASSR阈值分别从基线的106 dB和106 dB改善到治疗13周后的75 dB和78 dB。患者5的右耳和左耳的ASSR阈值分别从基线的88 dB和85 dB改善到治疗13周后的63 dB和63 dB。
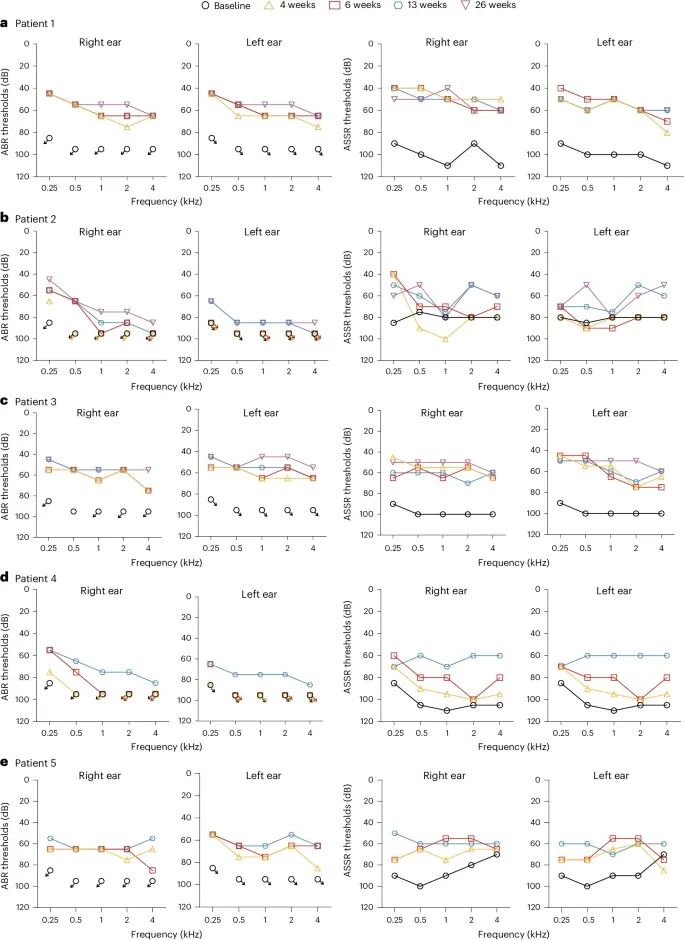
双侧基因治疗显著改善了所有五名DFNB9患者的听觉功能(Credit: Nature Medicine)
言语感知和声音源定位能力的恢复:所有患者的言语感知能力和声音源定位能力均有所改善。患者在治疗前的言语感知能力几乎为零,而在治疗后,患者能够识别和理解不同的声音和言语。这表明,基因治疗不仅恢复了患者的听力,还显著提高了他们的生活质量。
例如,在言语感知评估中,患者1的有意义听觉整合量表(MAIS)得分从基线的1分提高到26周后的28分,听觉表现类别(CAP)得分从基线的0分提高到26周后的4分。患者2的MAIS得分从基线的0分提高到26周后的35分,CAP得分从基线的0分提高到26周后的5分。患者3的MAIS得分从基线的0分提高到26周后的35分,CAP得分从基线的0分提高到26周后的5分。
在声音源定位能力评估中,所有患者的双耳均恢复了定位声音来源的能力。例如,患者1在治疗26周后的双耳根均方误差(RMSE)从基线的92.8°±1.1°改善到40.0°±1.7°。患者2的双耳RMSE从基线的93.5°±1.0°改善到26周后的42.0°±1.5°。这些结果表明,基因治疗显著改善了患者的声音源定位能力。
该研究展示了双侧基因治疗在治疗DFNB9中的巨大潜力。双侧基因治疗相比单侧治疗,能够提供更好的听力恢复效果,包括更好的言语感知能力和声音源定位能力。这对于患有双侧耳聋的患者尤为重要,因为恢复双侧听力能够显著提高他们的生活质量和日常交流能力。
此外,该研究还证明了AAV1-hOTOF基因治疗的安全性。在所有患者中,未出现严重不良事件或剂量限制毒性,这为未来进一步的临床研究奠定了基础。
基因治疗的发展前景:基因治疗作为一种革命性的治疗方法,正在迅速发展。除了听力障碍,基因治疗在其他遗传性疾病中的应用也取得了显著进展。例如,AAV载体在治疗血友病、脊髓性肌萎缩症和视网膜疾病等方面已显示出良好的疗效。这些研究成果为基因治疗在更广泛的疾病治疗中提供了重要的参考和借鉴。
未来的研究方向:尽管本研究显示了双侧基因治疗的良好效果,但仍需进一步的研究来验证其长期安全性和有效性。未来的研究可以考虑扩大样本量,延长随访时间,以更全面地评估基因治疗的长期效果。此外,探索基因治疗与其他治疗手段(如人工耳蜗植入)的联合应用,也可能为患者提供更多的治疗选择。
双侧AAV1-hOTOF基因治疗在DFNB9儿童患者中的应用显示出良好的安全性和有效性。该治疗方案不仅恢复了患者的听力,还显著改善了他们的言语感知能力和声音源定位能力。这项研究为遗传性听力障碍的治疗提供了新的希望,并为未来的基因治疗研究奠定了重要基础。随着科技的不断进步,基因治疗有望在更多遗传性疾病的治疗中发挥更大的作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


