2024年5月Cell期刊精华
来源:生物谷原创 2024-06-01 13:32
新的图谱针对基因如何在早期胚胎发育中起作用提供新见解、胎儿细胞可以追溯到人类胚胎发育的第一天、利用Perturb-seq技术大规模探究与关键发育基因相关的脑细胞类型
2024年5月份即将结束,5月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新的图谱针对基因如何在早期胚胎发育中起作用提供新见解
doi:10.1016/j.cell.2024.04.012
研究疾病如何在发育的早期阶段形成的生物医学工作,将受益于具体了解复杂生物是如何从单个受精卵细胞中产生的。在一项新的研究中,来自加州大学圣地亚哥分校的研究人员通过一种简单的模式生物,对胚胎发育如何展开有了新的认识。相关研究结果于2024年5月16日在线发表在Cell期刊上,论文标题为“Automated profiling of gene function during embryonic development”。
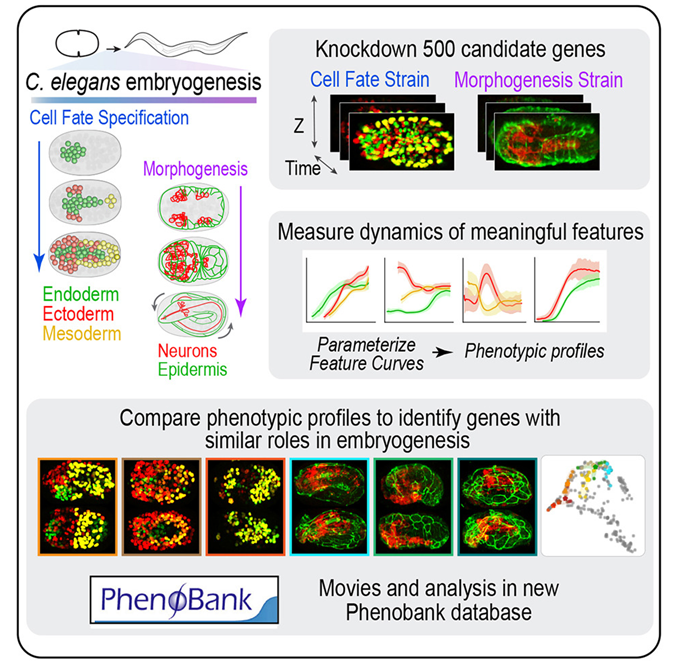
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.012
这些作者逐一介绍了秀丽隐杆线虫(Caenorhabditis elegans)胚胎发育过程中基因是如何发挥作用的。尽管体型微小,秀丽隐杆线虫一直是科学家们的研究对象,因为它的许多生物学特性,包括早期发育阶段,都与包括人类在内的高等生物非常相似。
论文第一作者Rebecca Green说,“通过在一种简单的模式生物中描述许多这些鲜为人知的基因,我们可以了解它们在像人类这样更复杂的系统中的作用。虽然这项研究是利用秀丽隐杆线虫完成的,但所分析的大多数基因都存在于人类中,其中许多基因的突变与人类发育障碍有关。”
这些作者开发了一种自动系统,用于分析胚胎发生所需的基因功能,其中胚胎发生是受精卵从单细胞发育成具有皮肤、消化道、神经元和肌肉等不同组织的有机体的过程。他们利用延时 4D 成像技术有条不紊地跟踪了每个基因在胚胎各个阶段的功能,包括细胞身份确定和有机体组织成形的时间。
他们使用一种称为“计算机视觉(computer vision)”的方法监控这一过程,以跟踪发育的特定方面,包括每个组织中的细胞数量。他们还跟踪了发育中有机体内组织的质量、位置和形状。
doi:10.1016/j.cell.2024.04.029
虽然已有 800 多万婴儿通过体外受精(IVF)出生,但 70% 的体外受精植入失败。随着体外受精成为不孕症患者更常见的怀孕途径,人们需要更好地了解胚胎在这一早期阶段的发育情况。
在一项新的研究中,加州理工学院生物学与生物工程学的Magdalena Zernicka-Goetz教授 Magdalena Zernicka-Goetz及其团队研究了人类早期发育的基本生物过程。他们发现在胚胎刚出生 1 天时,人类胚胎由两个细胞组成,其中一个细胞除了产生胎盘细胞外,还会产生大部分胎儿体细胞,而另一个细胞只会产生胎盘细胞。相关研究结果发表在2024年5月23日的Cell期刊上,论文标题为“The first two blastomeres contribute unequally to the human embryo”。
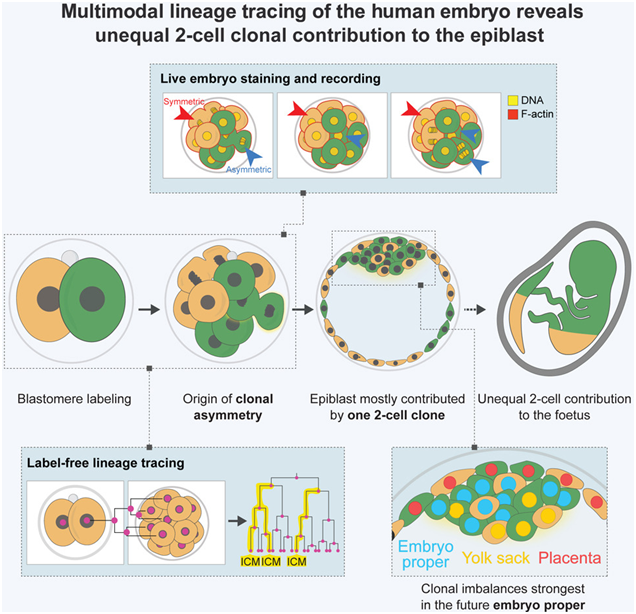
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.029
这项研究改变了人们长期以来的看法,即这两个细胞在这一阶段对发育中胚胎的所有部分都有同样的贡献,这表明“特化(specification)”——细胞具有特定个体作用的现象,在发育过程中比以前认为的要早得多。这些发现对如何评估准备用于试管婴儿植入的胚胎是否存在异常具有重要意义。
Zernicka-Goetz说,“在试管婴儿诊所,通常会从6天大的胚胎外部选取一些胎盘细胞进行基因诊断,以确定它们是否存在染色体异常。我们的研究结果表明,根据推断,这些被选中的外部细胞不太可能对胎儿的身体做出贡献。来自这些细胞的遗传信息可能不如对胎儿细胞本身取样那么有意义。”
3.Cell:利用Perturb-seq技术大规模探究与关键发育基因相关的脑细胞类型
doi:10.1016/j.cell.2024.04.050
大脑通常被称为“黑盒子”——很难窥探其内部,也很难确定在任何特定时刻发生了什么。这也是人们难以理解神经系统疾病背后复杂的分子、细胞和基因相互作用的部分原因。但是,在一项新的研究中,来自斯克里普斯研究所的研究人员开发的一种新的 CRISPR 筛选方法有可能为这些疾病发现新的治疗靶点和治疗方法。基于此,他们以前所未有的规模快速探究与关键发育基因相关的脑细胞类型,从而有助于揭示不同神经系统疾病的基因和细胞驱动因素。相关研究结果于2024年5月20日在线发表在Science期刊上,论文标题为“Massively parallel in vivo Perturb-seq reveals cell-type-specific transcriptional networks in cortical development”。
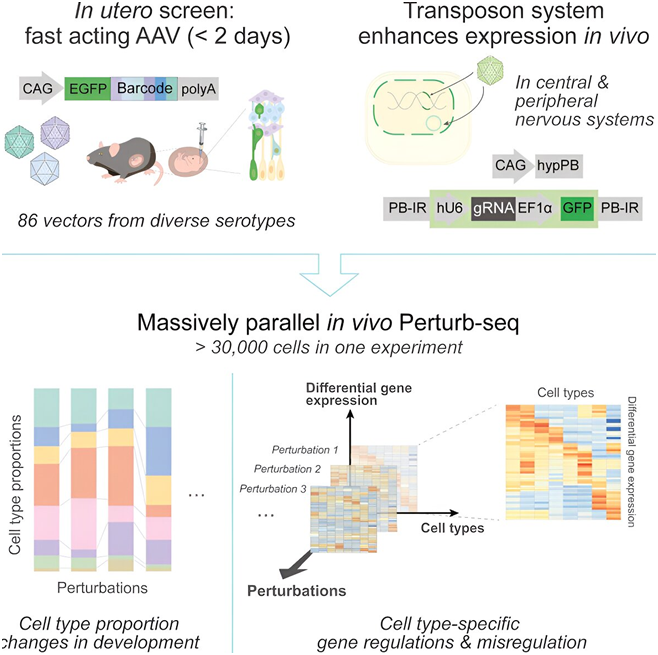
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.050
论文通讯作者、斯克里普斯研究所神经科学系助理教授Xin Jin博士说,“我们知道,基因组中的某些突变会使我们对不同疾病变得脆弱或有抵抗力,但疾病背后是哪些特定的细胞类型?哪些大脑区域容易受到这些细胞基因组突变的影响?这些都是我们试图回答的问题。有了这项新技术,我们希望建立一个跨大脑区域、跨细胞类型、跨疾病发展时间的更动态的图像,并真正开始了解疾病是如何发生的,以及如何设计干预措施。”
经过十多年在人类遗传学领域的努力,科学家们已经获得了一长串导致一系列人类疾病的基因变化清单,但了解一个基因如何导致疾病与了解如何治疗疾病本身是截然不同的。每个风险基因都可能影响一种或几种不同的细胞类型。了解这些细胞类型甚至单个细胞如何影响基因并影响疾病进展,是了解如何最终治疗该疾病的关键。
正因如此,Jin与论文第一作者、斯克里普斯研究所博士生Xinhe Zheng共同发明了一种名为体内Perturb-seq的新技术。这种方法利用CRISPR-Cas9技术和单细胞转录组分析,一次一个细胞地测量对细胞的影响。利用CRISPR-Cas9,他们可以在大脑发育过程中精确改变基因组,然后利用单细胞转录组分析密切研究这些变化如何影响单个细胞——数千个细胞同时进行。
4.Cell:新研究揭示ARID1A基因突变让癌症患者对免疫疗法敏感机制
doi:10.1016/j.cell.2024.04.025
近年来,免疫疗法彻底改变了我们治疗癌症的方式。免疫疗法不是靶向肿瘤本身,而是引导患者的免疫系统更有效地攻击肿瘤。这对改善某些难治癌症的治疗效果尤为有效。尽管如此,只有不到一半的癌症患者对目前的免疫疗法有反应,因此迫切需要确定生物标志物,以预测哪些患者最有可能获益。
最近,科学家们注意到,肿瘤中一个名为 ARID1A 的基因发生突变的患者更有可能对免疫检查点阻断疗法产生积极反应,其中这种免疫疗法的作用原理是让称为 T 细胞的抗癌免疫细胞处于“开启”状态,否则它们就会处于“关闭”状态。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.025
由于这种ARID1A基因突变存在于许多癌症中,包括子宫内膜癌、卵巢癌、结肠癌、胃癌、肝癌和胰腺癌,因此在一项新的研究中,来自索尔克研究所的研究人员想知道这种突变会如何影响治疗的敏感性,以及临床医生如何利用这些信息为每位患者量身定制癌症治疗方案。他们发现这种ARID1A突变通过一种类似抗病毒的免疫反应将抗癌免疫细胞吸引到肿瘤中,从而使肿瘤对免疫疗法敏感。相关研究结果于2024年5月15日在线发表在Cell期刊上,论文标题为“ARID1A suppresses R-loop-mediated STING-type I interferon pathway activation of anti-tumor immunity”。
这些作者认为,这种突变和抗病毒免疫反应可能能够作为一种生物标志物,用于更好地选择接受特定免疫疗法(如免疫检查点阻断疗法)的患者。这些研究结果还鼓励开发靶向ARID1A和相关蛋白的药物,使其他肿瘤对免疫疗法敏感。
论文通讯作者Diana Hargreaves副教授说,“这可能会真正改变患者的癌症治疗结果。这些ARID1A突变癌症患者已经有了免疫反应,所以我们需要做的就是利用免疫检查点阻断技术上调这种反应,帮助他们从内部摧毁肿瘤。”
5.Cell:新研究发现一种实验性HIV疫苗可在人体中诱导广泛中和抗HIV抗体产生
doi:10.1016/j.cell.2024.04.033
在一项新的研究中,杜克大学人类疫苗研究所的科研团队研发出一种新型HIV候选疫苗,在2019年的小规模临床试验中,成功激发了参与者体内产生广泛的中和抗体,对抗HIV病毒。
这一成就不仅证实了疫苗能够激发抗体以对抗多种HIV毒株,而且还能在数周内启动这一种重要的免疫反应。相关研究结果于2024年5月17日在线发表在Cell期刊上,论文标题为“Vaccine induction of heterologous HIV-1-neutralizing antibody B cell lineages in humans”。
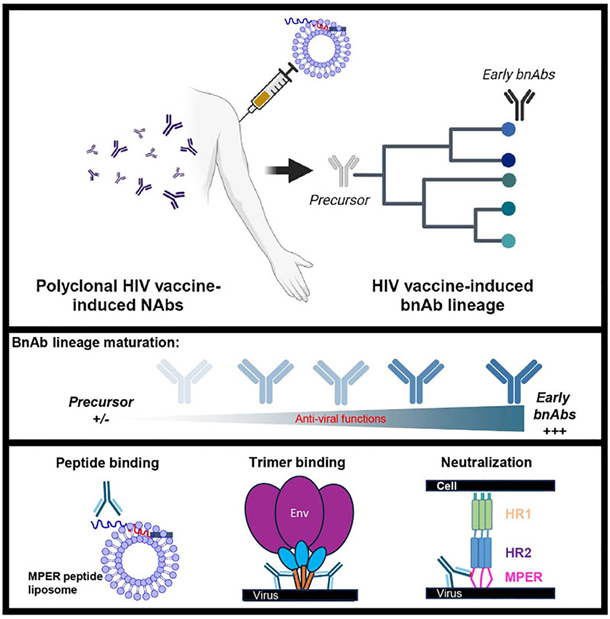
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.033
这种候选疫苗靶向HIV-1外包膜上一个叫做近膜端外部区(membrane proximal external region, MPER)的区域,这一区域即使在病毒变异中依旧稳定,为攻克HIV提供了稳定靶点。此区域的抗体能够拦截多种HIV流行株,展现出广泛防护潜力。
论文共同通讯作者、杜克大学人类疫苗研究所主任Barton F. Haynes博士说,“这项研究向前迈出了一大步,因为它证明了通过免疫系统产生对抗最棘手HIV株抗体的可能性。接下来,我们将致力于增强针对HIV其他位点的抗体,封堵住病毒逃逸路径。虽目前还未全胜,但方向已清晰。”
doi:10.1016/j.cell.2024.04.005
在一项新的研究中,当使用一种名为ESI1的新型蛋白功能抑制剂治疗时,模拟多发性硬化症(MS)症状的小鼠和实验室制备的人类脑细胞都显示出了再生至关重要的可以保护健康轴突功能的髓鞘外膜(myelin coating)的能力。这一突破性进展似乎克服了长期以来一直阻碍人们试图逆转神经损伤的困难,其中这种神经损伤会剥夺多发性硬化症患者的运动控制能力,并随着年龄的增长逐渐削弱许多人的认知功能。相关研究结果发表在2024年5月9日的Cell期刊上,论文标题为“Small-molecule-induced epigenetic rejuvenation promotes SREBP condensation and overcomes barriers to CNS myelin regeneration”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.005
论文共同通讯作者、辛辛那提儿童医院脑研究专家Q. Richard Lu 博士说,“目前,还没有有效的疗法来逆转多发性硬化症等破坏性脱髓鞘疾病中的髓鞘损伤。这些发现意义重大,因为它们提供了新的治疗途径,有可能将治疗重点从仅仅控制症状转移到积极促进髓鞘的修复和再生。”
这些作者搜索了一个包含数百种已知靶向可以改变基因表达并影响沉默的少突胶质细胞的酶的小分子的化合物文库。他们确定化合物ESI1(epigenetic-silencing-inhibitor-1)的作用比他们考虑过的其他化合物强近五倍。
这种化合物能将少突胶质细胞中所需的 H3K27ac 组蛋白标记水平提高三倍,同时大幅降低两种抑制性组蛋白标记—— H3K27me3和H3K9me3的水平。此外,这项新研究还揭示了ESI1能促进细胞核内产生称为“生物分子凝聚物(biomolecular condensates) ”的特殊无膜调控中心,从而控制脂肪和胆固醇水平。这些无膜调控中心可作为中心点,促进制造髓鞘(神经纤维的重要组成部分)所需的必需脂肪和胆固醇的产生。
7.Cell:随着年龄的增长,造血干细胞产生高反应性的次级血小板群体,从而导致凝血加剧
doi:10.1016/j.cell.2024.04.018
随着年龄的增长,人们更容易患上凝血疾病,这时称为血小板的血细胞会在不需要的时候凝结在一起,从而引发中风和心血管疾病等重大问题。几十年来,科学家们一直在研究为什么老年人的血细胞会有这种行为,并利用他们的见解开发了大量抗凝药物,这些药物现已上市,用于治疗美国人的主要死因。
如今,在一项新的研究中,加州大学圣克鲁斯分校生物分子工程学教授Camilla Forsberg和她的研究团队发现了一种独特的次级血小板群体,它们随着年龄的增长而出现,具有高反应性行为和独特的分子特性,这可能使它们更容易利用药物加以靶向。相关研究结果于2024年5月14日在线发表在Cell期刊上,论文标题为“An age-progressive platelet differentiation path from hematopoietic stem cells causes exacerbated thrombosis”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.018
这些作者追溯了这个血小板群体的干细胞起源,发现了有史以来首次发现的从干细胞到独特成熟血小板的年龄特异性发育途径。他们通过研究造血干细胞来解决这个问题。他们进行了实验,在小鼠模型中追踪这些造血干细胞的谱系,发现在老年小鼠中,一些血小板没有沿着分化途径行进。相反,它们采取了他们称之为“捷径”的途径,跳过中间步骤,立即成为巨核细胞祖细胞(megakaryocyte progenitor),即血小板生成前的血细胞阶段。据他们所知,这是迄今发现的第一条年龄特异性造血干细胞分化途径。
8.Cell:新研究发现着丝粒由两个亚结构域组成
doi:10.1016/j.cell.2024.04.014
着丝粒(centromere)是一种确保细胞分裂时染色体正确分离的结构。染色体分离错误可导致细胞死亡和癌症产生。在一项新的研究中,来自胡布勒支研究所和爱丁堡大学的研究人员在着丝粒的结构方面有了惊人的新发现。他们发现着丝粒由两个亚结构域组成。这一基本发现对染色体分离过程具有重要意义,并提供了癌细胞错误分裂的新机制。相关研究结果于2024年5月13日在线发表在Cell期刊上,论文标题为“Vertebrate centromeres in mitosis are functionally bipartite structures stabilized by cohesin”。
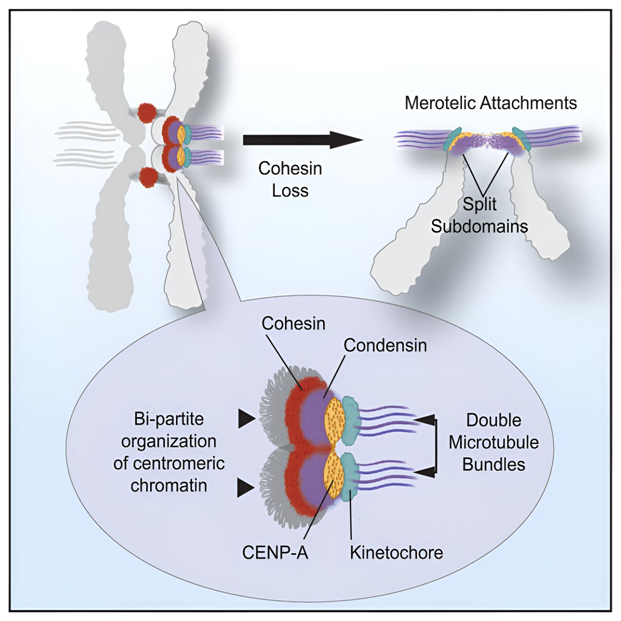
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.014
我们的身体由数万亿个细胞组成,其中大多数细胞的寿命有限,因此必须进行增殖以取代旧细胞。这种增殖过程被称为细胞分裂,或者说有丝分裂。在有丝分裂过程中,母细胞会复制它的染色体,以便将遗传物质传给子细胞。由此产生的一对相同的染色体,即姐妹染色单体,被一种叫做着丝粒的结构连接在一起。
接着,姐妹染色单体必须平均分配到两个子细胞中,以确保每个子细胞都是母细胞的精确复制品。如果在分离过程中出现错误,一个子细胞的染色体就会过多,而另一个子细胞的染色体则会过少。这可能导致细胞死亡或癌症产生。
9.Cell:新研究揭示血管周围神经元如何构建三维血管结构来保持视网膜健康
doi:10.1016/j.cell.2024.04.010
多年来,科学家们一直知道,视网膜中的细胞是由血管组成的网状结构滋养的,这种结构使我们能够看见东西,但这种错综复杂的结构是如何形成的一直是个谜。
如今年,来自加州大学旧金山分校的研究人员发现了一种新型神经元,它能引导血管的形成。这一发现有朝一日可能为治疗与眼睛和大脑血流受损有关的疾病带来新疗法。相关研究结果发表在2024年5月23日的Cell期刊上,论文标题为“Perivascular neurons instruct 3D vascular lattice formation via neurovascular contact”。
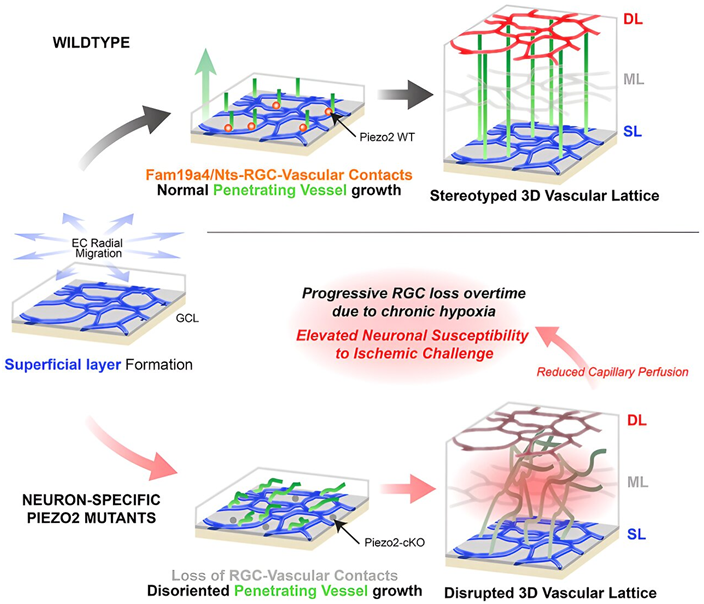
图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.010
论文通讯作者、加州大学旧金山分校眼科学副教授Xin Duan博士说,“这是第一次有人看到视网膜神经元直接接触血管,以此引导它们形成这些精确的三维晶格。这使我们更有可能在它们受损时进行修复,或者在它们一开始就没有建好时重新规划路线。”
doi:10.1016/j.cell.2024.04.003
在首次对四名成年患者进行的人体临床试验中,佛罗里达大学开发的一种 mRNA 癌症疫苗迅速对免疫系统进行重编程,以攻击最具侵袭性和致命性的脑肿瘤——胶质母细胞瘤。
这些结果反映了10名患有自然发生的脑肿瘤的宠物狗的治疗结果,由于它们没有其他治疗选择,这些患者的主人同意它们参与治疗,同时也反映了临床前小鼠模型的结果。如今,这项突破将在一项治疗脑癌的儿科1期临床试验中进行测试。相关研究结果发表在2024年5月9日的Cell期刊上,论文标题为“RNA aggregates harness the danger response for potent cancer immunotherapy”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.04.003
这一发现代表了一种潜在的新方法,即利用mRNA技术和脂质纳米颗粒的迭代来招募免疫系统对抗臭名昭著的治疗抵抗性癌症,该方法与COVID-19疫苗类似,但有两个关键区别:利用患者自身的肿瘤细胞来构建个性化疫苗,以及疫苗中新设计的复杂递送机制。
论文通讯作者、佛罗里达大学健康儿科肿瘤学家Elias Sayour说,“我们注射的不是单种颗粒,而是像洋葱一样包裹在一起的颗粒簇,就像一袋洋葱一样。我们之所以能在癌症的背景下做到这一点,是因为这些颗粒簇能以比单种颗粒更深刻的方式提醒免疫系统。”像其他免疫疗法一样,这种新开发的疫苗试图“教育”免疫系统来识别肿瘤是外来的。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


