为细胞装上高清显微镜?清华团队最新Cell研究
来源:清华大学医学院 2025-10-02 13:55
近日,清华大学基础医学院沈晓骅课题组开发了一项名为scFLUENT-seq的新技术,首次实现对单个细胞内基因转录活动的精准捕捉与实时观测。
你有没有好奇过,在一个微小细胞里,究竟有多少DNA正在“工作”?单细胞又是如何决定自己命运的?
近日,清华大学基础医学院沈晓骅课题组开发了一项名为scFLUENT-seq的新技术,首次实现对单个细胞内基因转录活动的精准捕捉与实时观测。研究成果以“单细胞新生转录揭示稀疏的基因组使用与可塑性”为题于9月26日在线发表于《细胞》(Cell)。
Cell网站论文截图
精准捕捉RNA“诞生瞬间”
在高等真核生物中,同一个基因组可“读出”数百种甚至上千种不同的细胞类型。基因通过转录生成RNA(核糖核酸),不仅指导蛋白质合成,也参与调控染色质和细胞核结构。虽然编码蛋白质的mRNA只占基因组约2%,但超过98%的基因组区域并不编码蛋白质,却可能被转录生成非编码RNA。这类非编码RNA通常水平低、随机性强、半衰期短,大多停留在细胞核内。
理解新生RNA的产生和调控对揭示基因组如何驱动多样化的细胞命运具有重要意义。“我们开发的scFLUENT-seq是一套‘抓活的基因产物’的技术方法。”团队人员介绍,“它的核心创新在于能够像为细胞装上‘高清显微镜’一样通过给新生RNA打上特殊标记,直接在细胞核内进行捕获和测序。”
与传统方法相比,该技术具有三大优势:精准捕获RNA起始信息、不遗漏关键片段、有效保留未加工RNA,真实反映基因工作状态,几乎无DNA污染,结果更加可靠。
使用新技术的两大惊人发现!
利用该技术,团队在胚胎干细胞、改造过的胚胎干细胞、脾脏细胞、胚胎成纤维细胞等四种细胞中进行实验发现,即使是最活跃的胚胎干细胞,同时工作的基因也不到基因组的3.1%。“相当于一本1000页的书,细胞同一时间只翻了31页。”已分化的脾脏细胞更为“懒惰”,基因活跃度不足干细胞的1/50。但将多个细胞的数据合并后,可覆盖80%的基因组。
“这一差异表明,单细胞转录极其稀疏、随机且异质。群体分析往往掩盖了此类细胞间差异。”团队人员解释。
此外,研究还揭示了非编码RNA在细胞命运决定中的重要作用。研究发现,占基因组98%的非编码区域,并非以往认为的"暗物质",而是表现出高度活跃且随机的转录特征。
基于此,团队提出“新生转录多样性”概念,用于识别瞬时、不稳定的细胞状态。这类细胞在稳态转录组中差异不明显,却在新生转录层面同时转录更多蛋白编码基因和非编码单元。反映出细胞处于动态过渡阶段,展现出更强的命运可塑性(plasticity)。
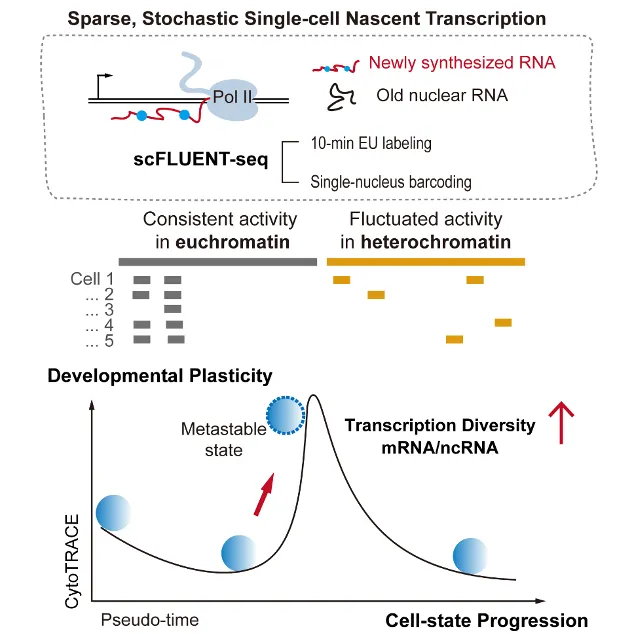
单细胞新生转录组检测和转录的异质性与可塑性
“细胞如何决定自己的命运”?
该研究不仅在技术上实现了单细胞新生转录的精准测量,也在理论层面回应了两个核心问题:非编码“暗物质”的转录活动,及生命调控的概率本质。通过定量揭示了新生转录的稀疏性和异质性,突破了稳态转录组的局限,为打破既有生物学范式、理解基因调控和细胞命运决定提供了全新框架。
“未来scFLUENT-seq技术能帮助人们更深入地理解‘细胞如何决定自己的命运’,为再生医学、癌症研究提供新的思路。”团队人员表示。
实验室简介
沈晓骅实验室研究非编码基因组转录、染色质折叠以及细胞核结构和功能的基本规律,探索微观概率下的调控机制和生命的物理与数学基础。团队通过细胞核物理建模,研究遗传信息解读的物理特性,揭示DNA、RNA、蛋白质到细胞表型的生命信息流及其程序化规律,为理解基因组功能和细胞命运提供新的理论框架。欢迎具有数理和工程背景的学生和博士关注和加入团队(xshenlab.com),共同探索生命科学的定量与本质问题。
论文链接:
https://doi.org/10.1016/j.cell.2025.09.003
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


