ASCO 2022 ▏优势明显!维迪西妥单抗治疗尿路上皮癌,最新数据更惊艳
来源:荣昌生物 2022-06-06 09:23
亮相ASCO 2022年会的最新数据显示:荣昌生物ADC新药维迪西妥单抗(Disitamab Vedotin, DV) 尿路上皮癌适应症不论是在联合PD-1方面,还是在单药治疗方面,都显示出优异疗效。

ASCO2022,一场有关RC48三项研究的主题讨论
图为Matthew. Galsky教授主持讨论的现场▲
6月4日,美国芝加哥,当地时间4:30PM-6:00PM,全球知名泌尿生殖医学肿瘤学专家、Tisch癌症研究所膀胱癌卓越中心联席主任、纽约西奈山医院(Mount Sinai Hospital) Matthew Galsky教授,主持了一场有关维迪西妥单抗三项重磅研究的特别讨论。这样的“专场”安排,在ASCO会议历史上并不多见。

Matthew. Galsky教授主持讨论的现场▲
从2017年起,荣昌生物研制的维迪西妥单抗已连续多年亮相国际肿瘤学“奥斯卡盛典”——ASCO(美国临床肿瘤学会)年会,持续为全球癌症患者带来惊艳的临床数据。此次ASCO年会上,荣昌生物以壁报讨论的形式公布了维迪西妥单抗的三项临床研究结果,再一次彰显了其在尿路上皮癌(UC)治疗领域的明显优势。

ASCO 2022 壁报示现场的RC48▲
总体而言,维迪西妥单抗不论是联合PD-1方面,还是在单药治疗方面,都显示出优异的疗效,且安全性可控:其一,维迪西妥单抗联合PD-1数据表明尿路上皮癌患者无论在治疗线数、HER2和PD-L1表达状态的情况下,均能从中获益,该研究结果亦证实了ADC维迪西妥单抗联合免疫治疗或可成为尿路上皮癌联合治疗领域的引领者。其二,维迪西妥单抗无论在HER2高表达还是低表达尿路上皮癌治疗领域均展现出优势,数据结果超越了晚期尿路上皮癌既有治疗药物的疗效,填补了国内外空白。同时,数据显示维迪西妥单抗对HER2低表达人群也有效,证明其具有更高的HER2亲和力和强大的旁杀效应的产品特征,在胃癌中也得到类似的结果,预示维迪西妥单抗有望在HER2低表达的各类实体瘤中占得先机。

Matthew. Galsky教授主持讨论现场的PPT▲
ASCO 2022 现场展示的RC48壁报▲

ASCO 2022 现场展示的RC48壁报▲
维迪西妥单抗是首款由中国公司自主研发的ADC新药。由于临床疗效显著优于现有治疗手段,用于治疗HER2过表达局部晚期或转移性尿路上皮癌适应症获得美国FDA和中国国家药监局突破性疗法认定,这在中国ADC药物领域尚属首次。2021年,维迪西妥单抗被纳入中国临床肿瘤学(CSCO)指南,确立了其在HER2过表达(免疫组化检查结果为2+或3+)尿路上皮癌的治疗地位。同年12月31日,尿路上皮癌适应症获得国家药监局批准上市。
以下为ASCO 2022 维迪西妥单抗研究详细数据:
01
摘要号:4518
题目
RC48-ADC联合特瑞普利单抗(toripalimab)在局部进展或转移性尿路上皮癌患者中的Ib/II期研究初步结果(RC48-C014试验,NCT04264936)
研究背景
RC48-ADC (Distamab Vedotin, DV)是一种新型人源化抗HER2抗体偶联药物(ADC)。在既往试验中,RC48-ADC对标准含铂治疗失败的HER2过表达的la/mUC患者,显示了不错的疗效。并且于2020年获得美国 FDA和中国CDE治疗mUC的突破性疗法的认定。
Toripalimab(JS001)是一种人源化的抗人PD-1 IgG4单克隆抗体,用于含铂化疗失败的mUC患者。在二线mUC治疗的POLARIS-03 (NCT03113266)中,cORR为26%,mPFS为2.3个月,mOS为14.4个月。
临床前研究表明,ADC与PD-1可能具有协同抗肿瘤作用。在前期临床试验结果的基础上,我们进一步探讨了RC48-ADC联合Toripalimab(JS001)治疗mUC患者的疗效和安全性。
研究方法
RC48-C014是一项Ib/II期研究者发起的临床研究(IIT),用于评估RC48-ADC(DV)联合toripalimab在la/mUC中的安全性和疗效。
研究结果
截至2022年4月22日,本研究的RP2D为 RC48-ADC 2mg/kg+JS001 3mg/kg,剂量递增期入组6例患者,剂量扩展期入组35例患者。
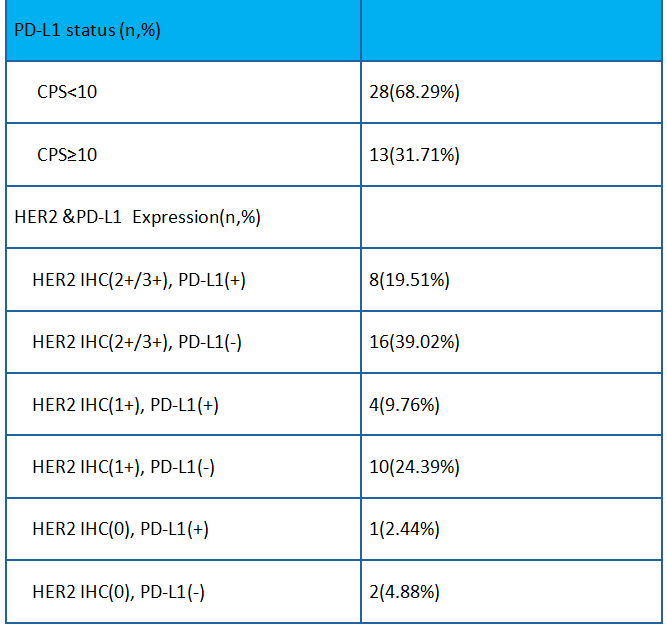
有效性
:截至2022年4月22日,39例至少有两次肿瘤评估的患者中,cORR为71.8% (95%CI: 55.1, 85),包括3例CR(7.7%),25例PR(64.1%); DCR为92.3% (95%CI: 79.1, 98.4)。一线cORR 为73.9%,六个亚组HER2 IHC(2 + /3 +) PD-L1 (+),HER2 IHC (2 + /3 +) PD-L1 (-), HER2 IHC (1+) PD-L1 (+),HER2 IHC (1+)PD-L1 (-),HER2 IHC (0) PD-L1 (+), HER2 IHC (0) PD-L1(-)的cORR分别为85.7%,86.7%,50%,60%,0%和50%。总体mPFS 为 9.2 个月,mOS未达到。
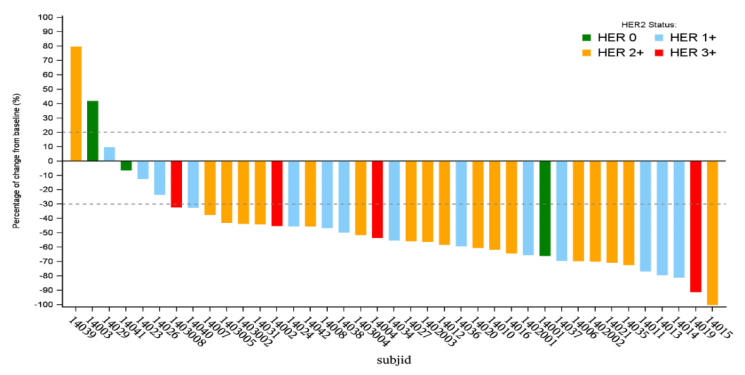
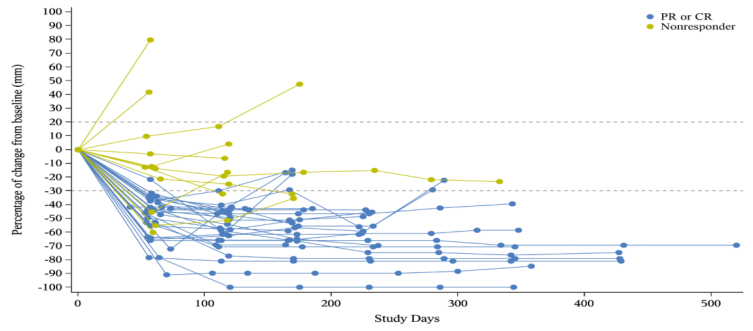
结论
RC48-ADC (DV)联合toripalimab在mUC患者中显示出良好的疗效。在mUC患者中,cORR为71.8%。随着HER2或PD-L1的表达增加,ORR值升高。在这项Ib/II期试验中,初治mUC患者的cORR为73.9%(17/23)。于2022年4月28日启动了一项针对一线mUC患者的RC48-ADC (DV)联合toripalimab对比含铂标准化疗的3期临床研究(NCT05302284)。
02
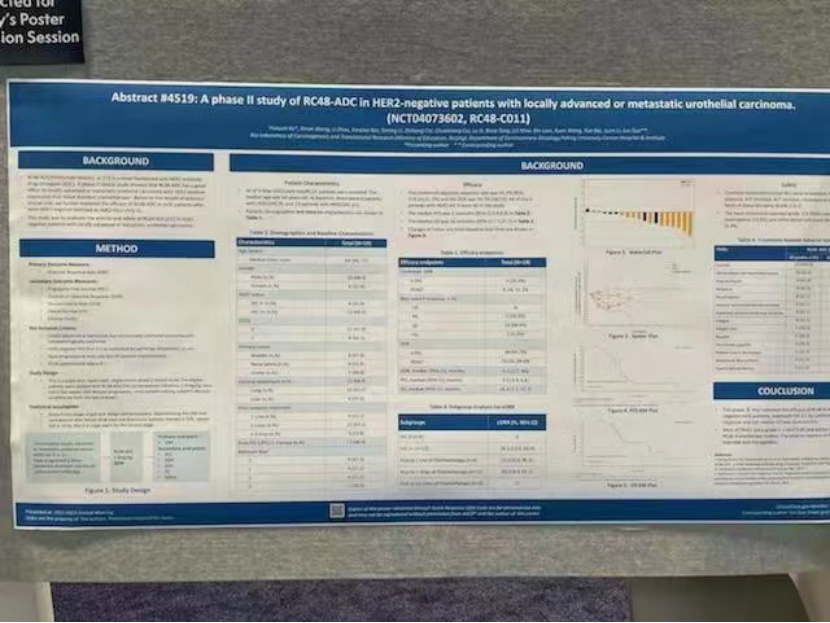
摘要号:4519
题目
RC48-ADC在HER2阴性的局部晚期或转移性尿路上皮癌患者中的II期临床研究
研究背景
RC48-ADC是一种新型人源化抗HER2抗体-药物偶联物(ADC)。既往的一项II期临床研究显示,RC48-ADC对于标准化疗失败的HER2表达阳性的局部晚期或转移性尿路上皮癌有很好的疗效。同时发现,部分免疫组化HER2阳性(IHC 2+)但FISH阴性的患者仍可以从RC48-ADC的治疗中获益。在前期临床试验的基础上,我们进一步探讨了RC48-ADC在HER2阴性(定义为HER2 IHC1+/IHC 0)的晚期尿路上皮癌患者中的疗效,开展本项研究。
研究方法
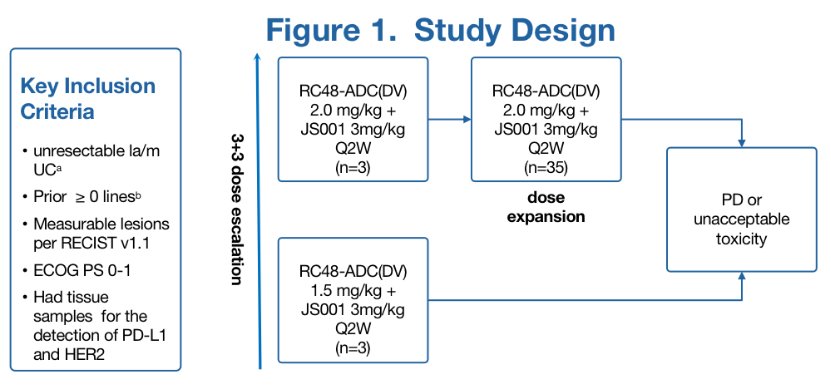
本研究是一项开放、单中心、单臂的II期临床试验。主要的入选标准包括:组织学证实的晚期尿路上皮癌,HER2阴性(IHC 0或1+),ECOG PS 0-1,既往接受过至少1次系统性治疗。患者接受RC48-ADC 2mg/kg 每2周一次治疗,直到疾病进展、不可接受的毒性、撤回同意书或研究终止。主要试验目的是观察抗肿瘤的有效性及安全性。主要研究终点是客观缓解率,次要研究终点包括无进展生存期、疾病控制率及总生存。
研究结果
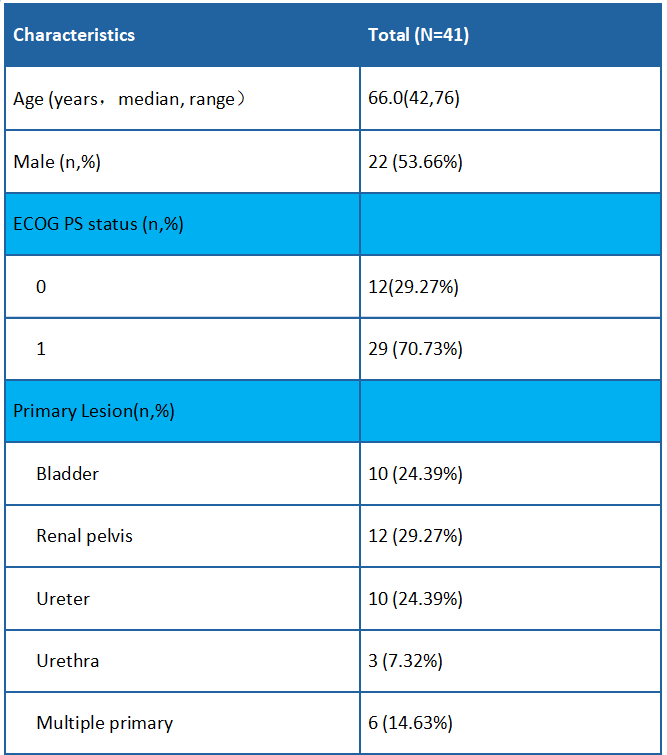
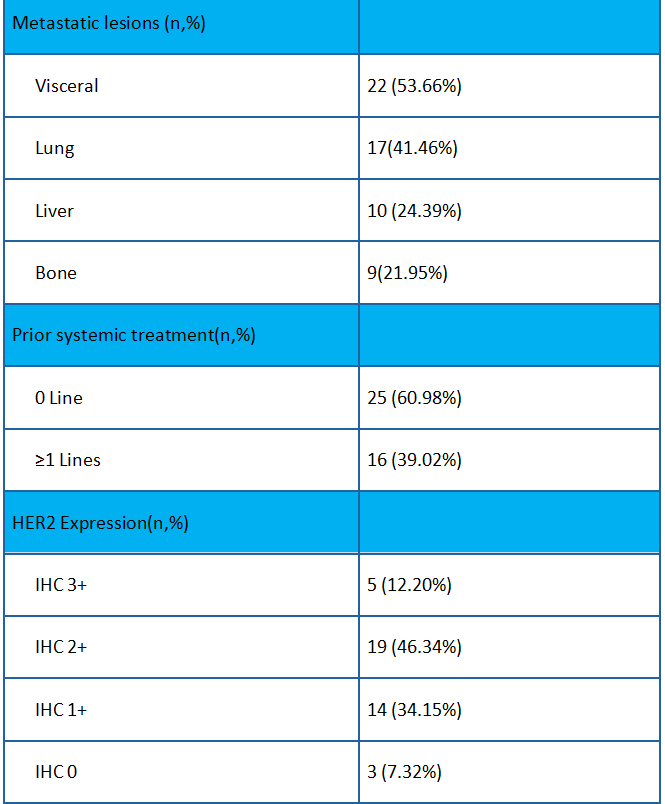
截止到2022年2月,研究入组了19例患者。中位年龄为64岁。其中6例患者HER2 IHC 0,13例患者HER2 IHC 1+。大多数患者(13/19)有内脏转移。15例(79%)患者接受了至少2线系统治疗。

表1 人口学及疾病基线特征
在截止日期进行统计,19例患者可评估疗效。客观缓解率为26.3% (95% CI:9.1%,51.2%), 疾病控制率为94.7%(18/19)。中位无进展生存期为5.5个月(95% CI:3.9,6.8),中位生存期为16.4个月(95% CI:7.1,21.7)。6例HER2 IHC 0患者的最佳疗效均为疾病稳定(SD)。HER2 IHC 1+患者的客观缓解率为38%(5/13),内脏转移患者的为31%(4/13),肝转移患者的为17%(1/6),≥2线系统治疗患者的为27%(4/15)。
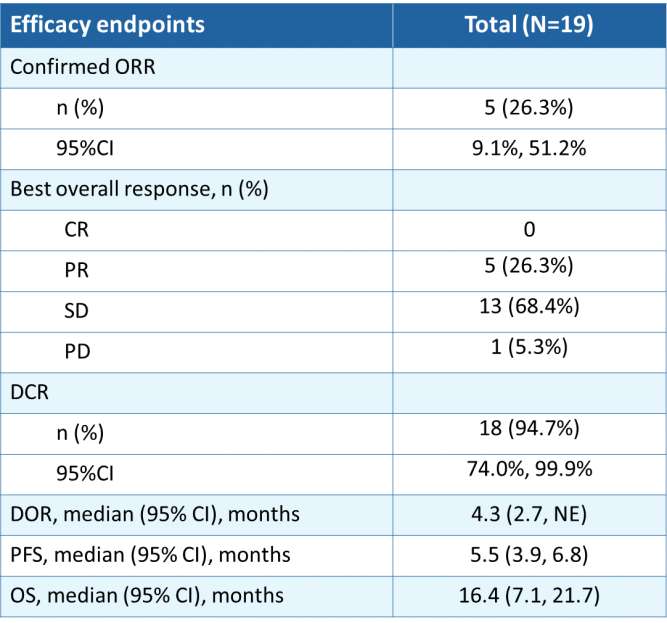
表2 有效性终点
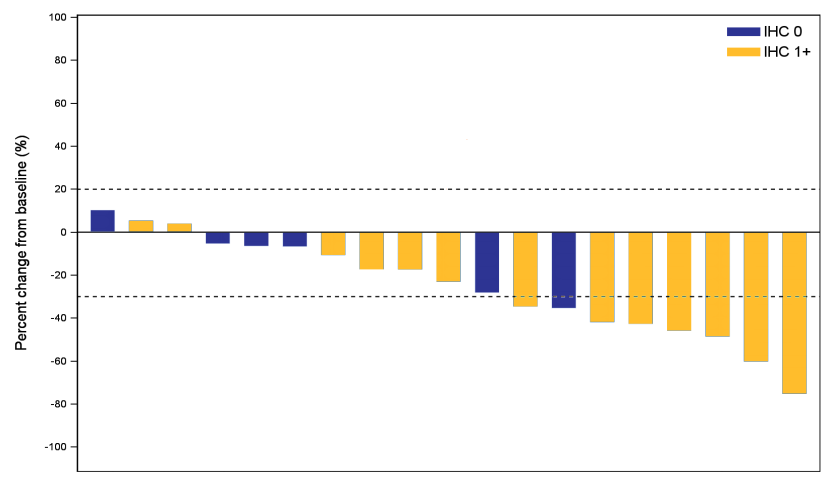
图1 瀑布图
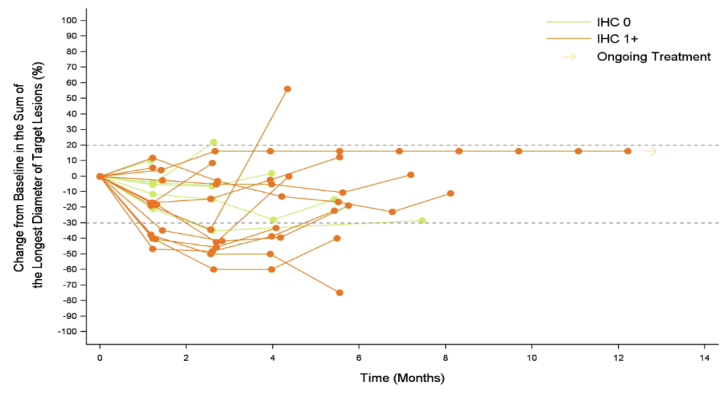
图2 蜘蛛图
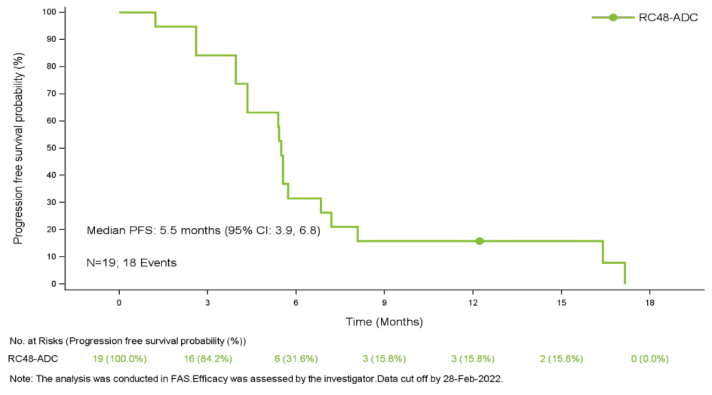
图3 PFS K-M曲线
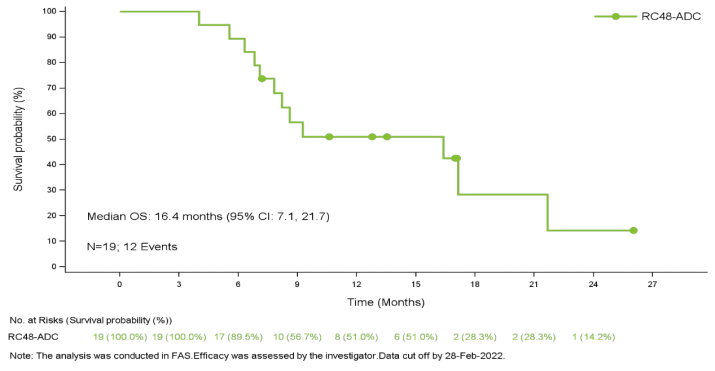
图3 OS K-M曲线
常见的治疗相关不良事件包括白细胞减少(52.6%)、感觉减退(47.4%)、脱发(47.4%)、AST升高(42.1%)、ALT升高(42.1%),中性粒细胞减少(42.1%)、疲劳(42.1%)、恶心(26.3%)、呕吐(15.8%)。这些不良事件大多数是1级或2级。3级的不良事件为中性粒细胞减少(10.5%)。与RC48-ADC相关的严重不良事件仅有1例,为血磷酸肌酸激酶增加。
结论
本项Ⅱ期临床试验证实了RC48对HER2阴性晚期尿路上皮癌患者的疗效,特别是IHC 1+患者的疗效,总体的中位OS为16.4个月。大多数治疗相关不良事件为1-2级,与以往的RC48单药治疗研究相似。RC48不良反应可耐受、可控。RC48-ADC在HER2阴性晚期尿路上皮癌中安全有效。
03
摘要号:4520
题目
RC48-ADC治疗HER2过表达(免疫组化检查结果为2+或3+)转移性尿路上皮癌:RC48-C005和RC48-C009临床试验的综合分析
研究背景
RC48-ADC(Disitamab Vedotin,DV)是一种新型的人源化抗HER2抗体药物偶联物(ADC)。在RC48-C005和RC48-C009临床试验中,RC48-ADC(DV)对HER2过表达(免疫组化检查结果为2+或3+)局部晚期或转移性尿路上皮癌(LA/mUC)患者显示出良好的疗效和可控的安全性。基于RC48-C009临床试验结果,中国药监局于2022年1月附条件批准了RC48-ADC(DV)用于治疗既往接受过铂类化疗的HER2过表达(IHC2+或3+)LA/mUC的患者。以下是两项研究的汇总分析,包括近期更新的疗效、安全性和OS数据。
研究方法
这两项试验均为单臂多中心II期临床试验。符合入组的患者为年龄在18~80岁、经中心实验室确诊的组织学HER2过表达(IHC2+或3+)、不可切除的mUC患者。患者至少接受过一次全身化疗(其中64.5%的患者接受了≥ 2线全身化疗,90.7%的患者有内脏转移)。主要研究终点是客观缓解率(ORR),同时评估了无进展生存率(PFS)、总生存率(OS)和安全性。
研究设计
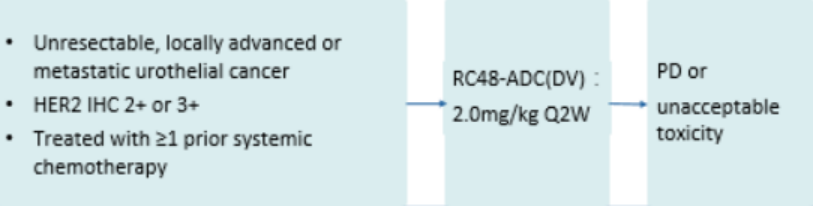
研究结果
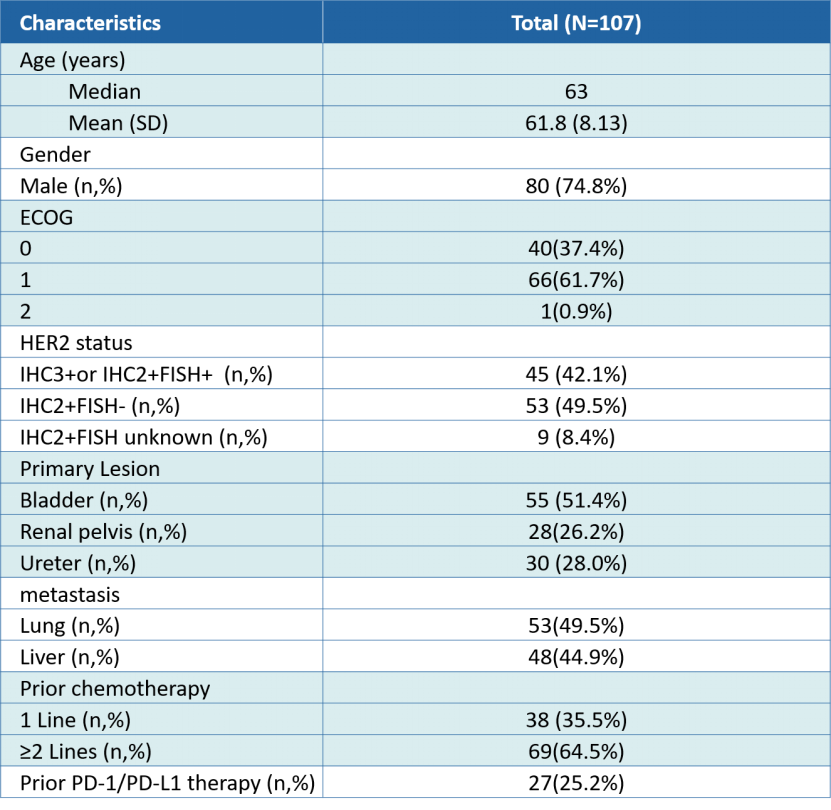
自2017年11月至2020年9月,RC48-C005和RC48-C009共入组 107名HER2过表达(IHC2+或3+)LA/mUC患者, 其中包括80名男性,中位年龄63岁[40-79]。
表1.病人基线特征
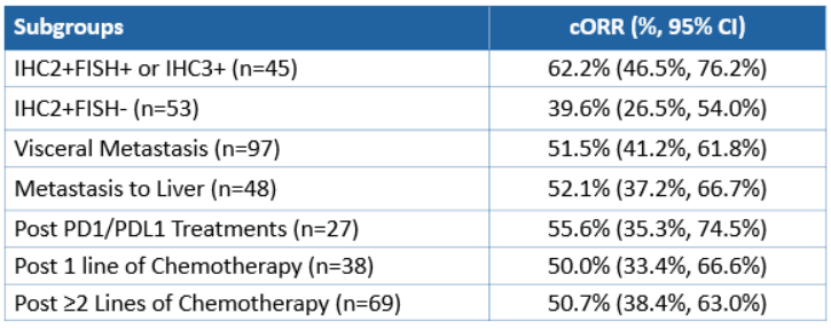
经IRC评估的cORR为50.5%。BOR为CR 1例,PR 53例,SD 34例。DCR为82.2%。在预先设定的亚组中观察到相似的疗效应答。肝转移患者的cORR为52.1%(25/48),而既往PD-1/L1治疗患者的cORR为55.6%(15/27)。HER2 IHC2+且FISH+或IHC3+患者的cORR为62.2%(28/45),HER2 IHC2+且FISH未知患者的cORR为55.6%(5/9),HER2 IHC2+且FISH-患者的cORR为39.6%(21/53)。
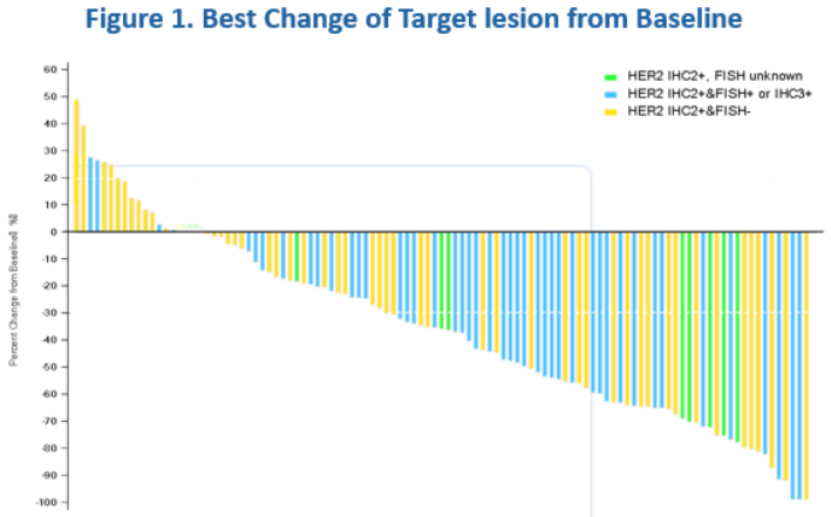
表2 亚组分析
107名受试者的平均OS随访时间为19.1个月。在这两项临床试验中,中位OS均超过1年,在当前的汇总分析中,mOS为14.2个月,持续延长。mPFS为5.9个月(95%CI:4.1,7.2)。
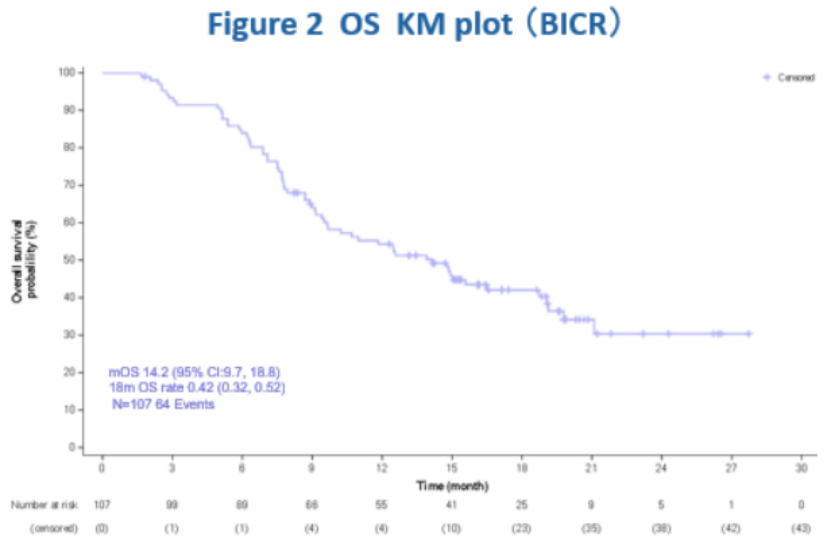
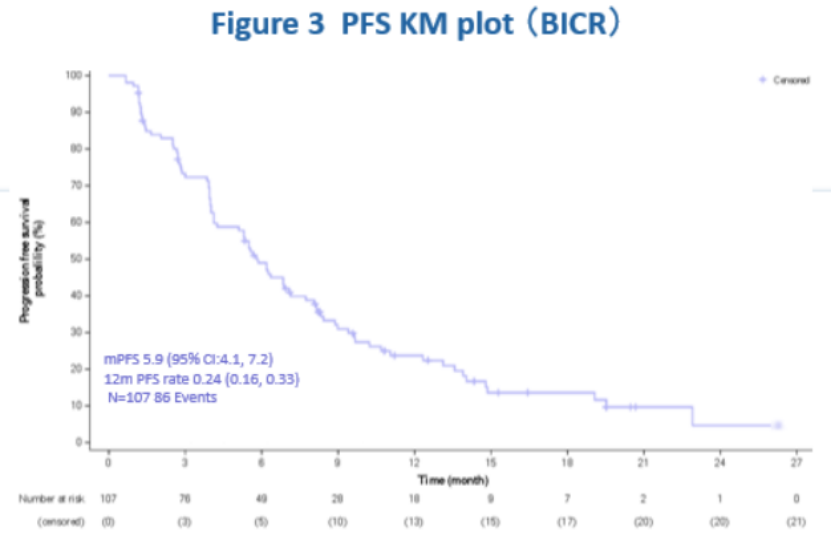
最常见的治疗相关不良反应(TRAE)为感觉减退(50.5%)、白细胞减少症(49.5%)、天冬氨酸转氨酶升高(42.1%)、中性粒细胞减少症(42.1%)、脱发(40.2%)、乏力(39.3%)、丙氨酸转氨酶升高(35.5%)、食欲下降(31.8%)。
58名(54.2%)受试者发生级别≥3级TRAE。但是级别≥3级TRAEs(≥5%)仅包括感觉减退(15.0%)、中性粒细胞减少(12.1%)和r-GT升高(5.6%)。
结论
RC48-ADC(DV)可以显著提高既往接受过至少一次全身化疗的HER2过表达(IHC2+或3+)LA/mUC患者的缓解率,并显示长期生存益处以及可管理的安全性。在预先设定的亚组中也观察到类似的疗效反应,如既往接受I-O药物治疗的患者,内脏转移患者。
临床试验信息:NCT03507166, NCT03809013.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


