上海交大凌代舜/李方园团队开发人工代谢酶,用于肿瘤细胞特异性代谢治疗
来源:生物世界 2024-08-07 13:15
该研究在癌症治疗中引入了一种创新范式,通过人工代谢酶的干预,肿瘤细胞在代谢上被重新编程,以自主调节并直接与免疫细胞相互作用,用于肿瘤细胞特异性代谢治疗。
上海交通大学变革性分子前沿科学中心凌代舜教授团队和上海交通大学医学院李方园教授团队合作,在 Nature Nanotechnology 期刊发表了题为:An artificial metabzyme for tumour-cell-specific metabolic therapy 的研究论文。
该研究首次开发了一种具有代谢酶活性的“人工代谢酶”——FeMoO4纳米催化剂,其具有双活性中心——铁(Fe2+)和四面体钼(Mo4+),反映了典型代谢酶黄嘌呤氧化酶(XOR)的特征结构。通过空间动态代谢组学结合肿瘤相关代谢物的评估,该研究证明 了FeMoO4代谢酶催化肿瘤中丰富的黄嘌呤代谢转化为尿酸,随后的代谢调整协调了与免疫细胞的串扰,实现了精准的肿瘤特异性的代谢激活免疫治疗,为癌症提供了一种新的潜在治疗途径。
该研究在癌症治疗中引入了一种创新范式,通过人工代谢酶的干预,肿瘤细胞在代谢上被重新编程,以自主调节并直接与免疫细胞相互作用,用于肿瘤细胞特异性代谢治疗。

类酶纳米催化剂(也称为纳米酶)的出现具有变革性潜力,能够克服困扰天然酶的内在限制,包括成本、稳定性和复杂的保存等问题。在过去的几十年里,纳米酶领域以惊人的速度蓬勃发展,涵盖了大量精心设计的材料,旨在模拟各种天然酶,包括氧化还原酶、水解酶、裂合酶等等。然而,制造具有多金属代谢酶样特征的合成纳米酶仍是一项艰巨的挑战。在原子尺度上,协调高异质金属原子负载量和原子嵌入金属氧化物基质中的活性催化位点的复杂性,是一个有待解决的难题。
在这项最新研究中,研究团队的灵感源自典型的代谢催化剂——黄嘌呤氧化酶(XOR),其涉及黄嘌呤(Xanthine)向尿酸(UA)的转化,其特点是基于铁(Fe)和四面体钼(Mo)的双重催化辅因子。XOR与各种癌症(尤其是XOR表达水平低的癌症)预后不良相关,突显了其对炎症反应的影响。
此外,还有研究显示了某些黄嘌呤衍生物免疫抑制特性以及尿酸在增强抗肿瘤免疫方面的显著作用,强调了XOR在这项研究过程中的关键相关性。利用这一见解,研究团队设计了一种独特的腐蚀-吸附-固定化程序,通过将铁原子以1:1的化学计量比掺入到MoO3-x催化剂中,并伴随着原子重排成四面体催化框架,来合成FeMoO4纳米催化剂,作为一种人工代谢酶, 随后出现的代谢酶作为一种兼具Fe2+和四面体Mo4+活性中心的构建体,无缝模拟了XOR催化。
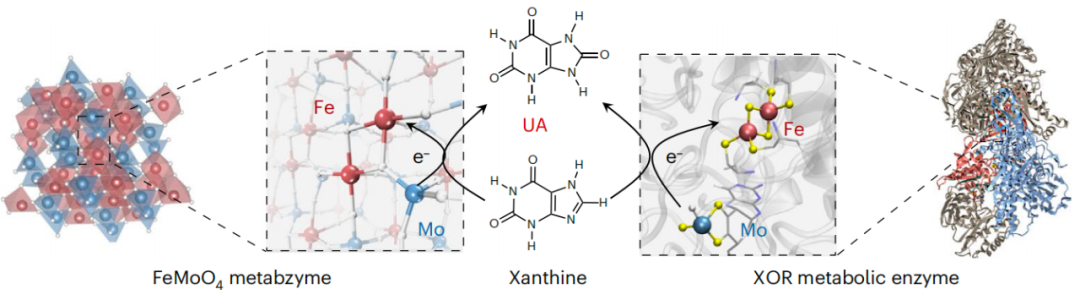
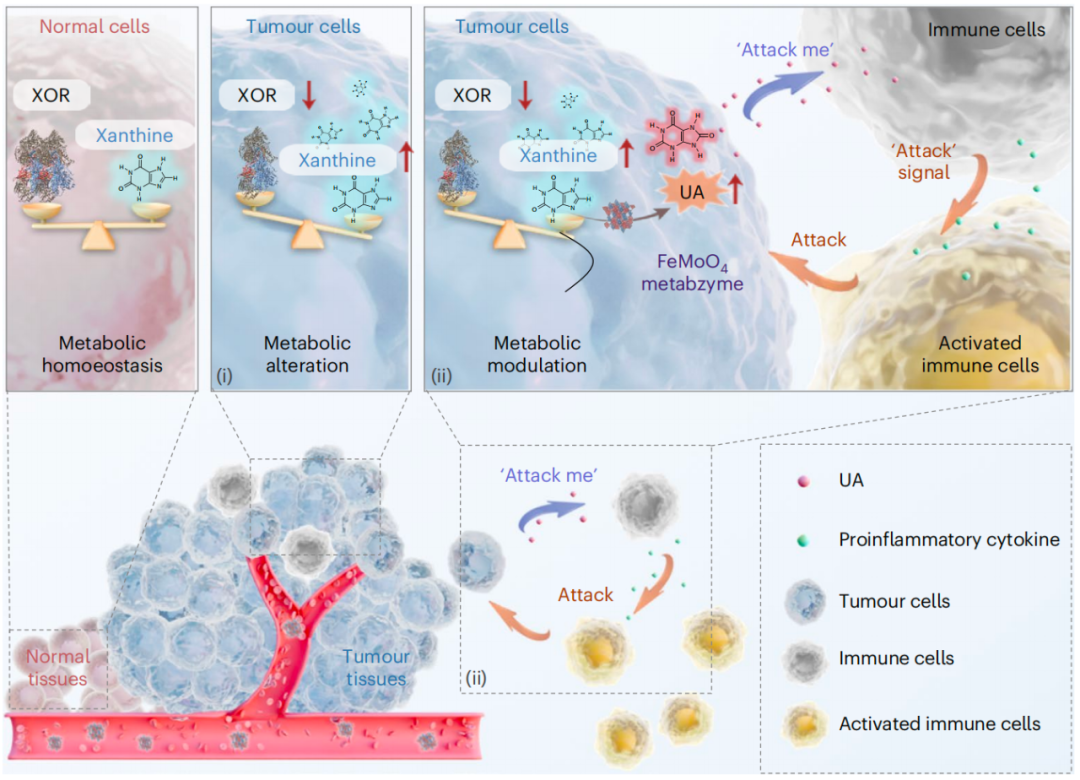
当其到达含有低水平XOR和升高的黄嘌呤底物的肿瘤细胞时,FeMoO4代谢酶能够熟练地促使黄嘌呤快速转化为过量的尿酸(UA),随后无缝地触发巨噬细胞分泌促炎细胞因子(例如IL-1β),从而驱动具有免疫刺激作用的M1型巨噬细胞的极化,以及其他免疫细胞(例如树突状细胞和T细胞)的激活。
有趣的是,这种代谢调节促进了与免疫细胞的细胞间代谢串扰(Crosstalk),以影响其功能和命运决策,对肿瘤细胞发起协同攻击——这种协同作用推动了靶向肿瘤细胞的特异性代谢治疗。
由于肿肿瘤内PD-1/PD-L1表达上调,FeMoO4代谢酶具有与免疫检查点抑制剂协同作用的潜力,实验结果显示,FeMoO4代谢酶显著抑制了B16黑色素瘤的肿瘤生长,并且在与抗PD-1抗体协同作用时取得了更优越的治疗效果,进一步抑制了肿瘤生长速率,延长了小鼠生存期。FeMoO4代谢酶具有克服免疫抑制性肿瘤微环境(TME)和增强肿瘤PD-L1表达的潜力,可能为提高检查点抑制剂反应率提供了一个强有力的替代方案。

该研究开发的人工代谢酶展示了在代谢层面上对肿瘤细胞进行靶向工程的潜力,它本身就像是一个引发免疫系统激活的“火花”。 总的来说,该研究在癌症治疗中引入了一种创新范式,通过人工代谢酶的干预,肿瘤细胞在代谢上被重新编程,以自主调节并直接与免疫细胞相互作用,用于肿瘤细胞特异性代谢治疗。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


