Nature子刊:李国玲/胥春龙/杨辉/吴士文/王柠团队利用AAV递送碱基编辑器,治疗DMD
来源:生物世界 2024-07-16 15:52
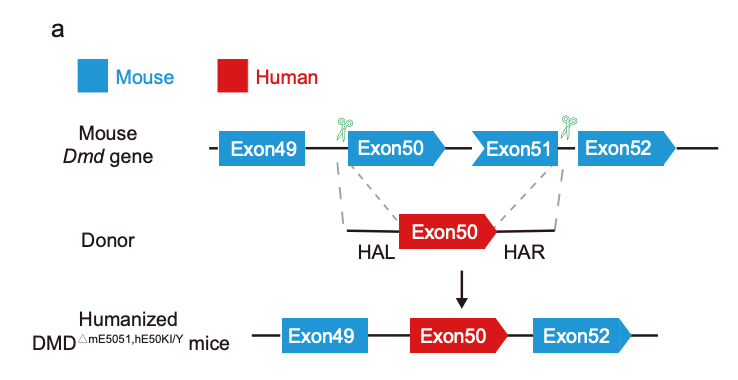
研究团队使用人源DMD外显子50替换小鼠DMD外显子50和51,构建了一个基因人源化DMD小鼠模型,模拟DMD缺失突变并可靠地重现人类DMD表型。
福建医科大学第一附属医院李国玲、临港实验室胥春龙、辉大基因杨辉、中国人民解放军总医院第一医学中心吴士文、福建医科大学第一附属医院王柠等人在 Nature 子刊 Nature Communications 上发表了题为:Adenine base editing-mediated exon skipping restores dystrophin in humanized Duchenne mouse model 的研究论文。
该研究使用腺嘌呤碱基编辑器(ABE)介导的外显子跳跃,在人源化杜氏肌营养不良(DMD)小鼠模型中恢复了肌营养不良蛋白表达,通过腺相关病毒(AAV)载体全身系统性递送ABE治疗的DMD小鼠肌肉功能得到了显著改善。

之前的研究表明,通过Cas9或其他核酸酶破坏移码外显子可以恢复功能性抗肌萎缩蛋白的表达。然而,核酸酶诱导的DNA双链断裂(DSB)不仅能够校正DMD等位基因,还会产生很大一部分携带插入或缺失突变(indel)且未经校正的DMD等位基因,此外,Cas9切割DNA后还可能诱导具有有害影响的大型DNA重排。
值得注意的是,以前大多数关于基因编辑治疗的研究并非基于基因人源化的DMD小鼠模型,这阻碍了它们使用人类特异性单向导RNA(sgRNA)来测试治疗效果和脱靶情况。因此,有必要使用高精度且安全的基因编辑工具直接编辑和校正人类DMD基因突变。
近来,腺嘌呤碱基编辑器(ABE)正成为一种颇具吸引力的基因编辑方式,它能够在不造成DNA双链断裂的情况下实现精确的碱基转换,从而纠正基因突变。
为了探究ABE在治疗由外显子缺失突变(占DMD患者的70%)引起的大多数DMD类型中的疗效,研究团队使用人源DMD外显子50替换小鼠DMD外显子50和51,构建了一个基因人源化DMD小鼠模型,模拟DMD缺失突变并可靠地重现人类DMD表型。然后,研究团队使用ABE治疗这些人源化DMD小鼠模型,通过诱导人源DMD外显子50跳跃,成功恢复了全身抗肌萎缩蛋白的表达,强有力地恢复了小鼠心脏、胫骨前肌和膈肌中肌营养不良蛋白的表达。
重要的是,通过腺相关病毒(AAV)载体全身系统性递送ABE治疗的DMD小鼠肌肉功能显著改善,将DMD小鼠的肌肉功能改善到与野生型小鼠相似的水平。这表明腺嘌呤碱基编辑器(ABE)在治疗最常见的杜氏肌营养不良(DMD)类型和其他单基因疾病的治疗干预方面具有巨大潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


