Cell:不依赖于传统树突状细胞抗原呈递的免疫通路
来源:BioArt 2025-12-03 10:41
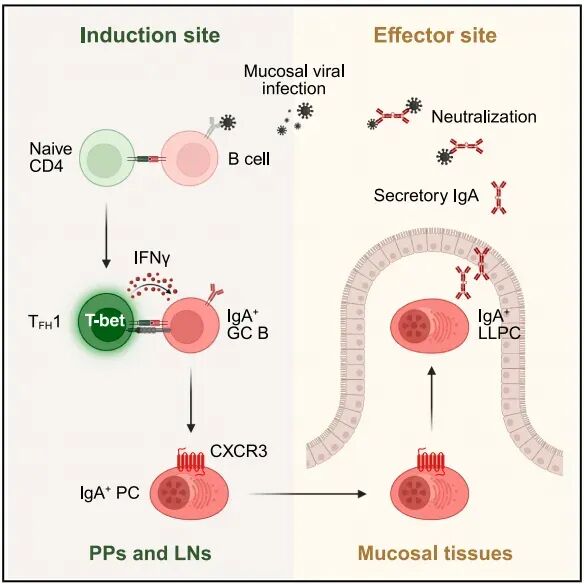
这项此研究不仅发现B细胞抗原提呈介导的TFH1细胞通过IFNγ-CXCR3指导长寿命IgA反应的新型免疫通路,更揭示不同黏膜位点对于长效保护性抗体产生的抗原提呈的差异。
许多病原体通过肠道和呼吸道等黏膜表面入侵,如轮状病毒、流感病毒和SARS-CoV-2等。众所周知,黏膜部位由浆细胞分泌的抗体尤其是IgA提供保护性免疫。然而,很多现有疫苗并不能提供强大且持续的黏膜IgA免疫反应,导致针对黏膜病原微生物的疫苗防护失败【1】。因此,对黏膜病毒特异性IgA长寿命浆细胞(long-lived plasma cells,LLPCs)诱导、调控和持久性的分子机制需要进一步阐释。
传统观点认为,在二级淋巴组织,传统树突状细胞(conventional dendritic cell,cDC)作为抗原提呈细胞通过MHC-II和共刺激分子激活CD4 T细胞,后者迁移至T-B交界处与同源抗原的B细胞结合分化为滤泡辅助T细胞(TFH)并与活化的B细胞形成生发中心(germinal center,GC)【2,3】。紧接着,B细胞经历类别转换和抗体亲和力成熟进一步分化为浆细胞(plasma cell,PC)。PC迁移至效应位点如骨髓等位置发挥作用,部分PC则分化为LLPC【4】。尽管如此,对于LLPC的认识多来自于IgG反应,而黏膜IgA反应则不十分清楚。
近日,Cell杂志在线发表加拿大多伦多大学免疫系Jennifer L. Gommerman团队题为Mucosal viral infection elicits long-lived IgAresponses via type 1 follicular helper T cells 的研究文章。该研究揭示一条不依赖于传统树突状细胞抗原呈递的免疫通路,该通路由B细胞抗原提呈诱导TFH1形成,后者通过 IFNγ-CXCR3 轴指导产生病毒特异性IgA的浆细胞定植到黏膜效应部位发挥功能,为未来黏膜病毒的疫苗设计提供新的思考。

首先,作者使用小鼠轮状病毒株(ECw)在野生型小鼠中建立急性感染模型。轮状病毒刺突蛋白VP4是产生中和保护抗体的靶点,中间衣壳蛋白V6具有高度免疫原性。通过构建重组VP4和VP6以及荧光素标记的抗原四聚体,作者在派氏结、肠道引流淋巴结、骨髓和肠黏膜固有层(SILP)动态监测VP4-和VP6-特异性的IgA+和IgG+PC和GC B细胞。流式分析确认轮状病毒感染在肠道诱导IgA和IgG反应。
随后,作者使用CD40L阻断抗体和CD4 T细胞特异性Bcl6敲除小鼠(Bcl6ΔT)证实轮状病毒诱导有效的IgG+和IgA+反应需要TFH细胞的辅助。虽然VP4-和VP6-特异性的IgA+ PCs在感染后14-28天达到顶峰且在200天SILP仍存在,但VP4-和VP6-特异性的IgG+ PCs仅存在于骨髓。流式分析同样证实SILP存在IgA+LLCPs(Ki-67-TIGIT-Ly6A+)。与此同时,这些LLCPs克隆产生的IgA输入B细胞缺陷的JHT小鼠具有防御轮状病毒的保护功能。总之,这些结果表明轮状病毒感染在肠道诱导TFH依赖的长效IgG+和IgA+反应。
紧接着,作者构建B细胞MHC-II(H2-Ab1fl/flMb1Cre,MHC-IIΔB)和cDC细胞MHC-II(H2-Ab1fl/flZbtb46Cre,MHC-IIΔcDC)缺失小鼠。轮状病毒感染引起的骨髓和SILP IgA+和IgG+PCs和派氏结IgA+和IgG+ GC B细胞在MHC-IIΔB小鼠数量显著降低,提示B细胞抗原提呈对于轮状病毒特异性IgA+和IgG+ PCs的发育至关重要。有趣的是,在MHC-IIΔcDC小鼠,IgG+PCs和IgG+ GC B细胞数量显著降低,而骨髓和SILP IgA+ PCs和派氏结IgA+ GC B细胞未受到影响,提示轮状病毒特异性IgA+ LLPCs发育并不依赖cDCs的抗原提呈。不仅如此,作者在只有B细胞表达MHC-II的小鼠(H2-Ab1LSL/LSLCd19Cre,MHC-IIB+)中发现,B细胞抗原提呈足以在肠道诱导功能性轮状病毒特异性IgA+PCs。
总之,这些数据表明B细胞MHC-II介导的抗原提呈对于轮状病毒特异性IgA+ LLPCs发育既是必要的也是充分的。
考虑到TFH存在不同亚群且对抗体的类别有不同作用,作者研究轮状病毒特异性TFH。为此,作者设计荧光素标记的VP4:I-Ab和VP6:I-Ab四聚体,并在感染第7天分选纯化派氏结和肠道引流淋巴结中结合在VP4:I-Ab和VP6:I-Ab四聚体的CD4 T以及全部CD T细胞行scRNA-seq分析。结果发现VP4:I-Ab和VP6:I-Ab四聚体结合的细胞主要是Th1(Tbx21、Ifng、Cxcr3和Cxcr6)和TFH细胞(Bcl6 和Cxcr5)。其中,一群TFH细胞高表达c-Myc、Tbx21、Ifng、Cxcr3和Bcl6,类似于Th1细胞亚群,作者将其命名为TFH1细胞。
随后,作者在MHC-IIΔB和MHC-IIΔcDC小鼠中证实B细胞而非cDC的抗原呈递是对于TFH1细胞的诱导和成熟是必须的。基于这些结果,作者推测TFH1细胞对IgA反应至关重要。在TFH1缺陷骨髓嵌合子小鼠中发现TFH1细胞对派氏结中IgA的产生无影响,但对于IgA+ LLPCs迁移至SILP是必要的。scRNA-seq数据和流式分析显示TFH1细胞高表达IFNγ。骨髓嵌合子实验证实TFH1细胞来源IFNγ对于SILP中轮状病毒特异性IgA+ LLPCs稳态至关重要。
研究表明IFNγ上调T细胞和NK细胞CXCR3【5】,作者推测IFNγ上调CXCR3促进轮状病毒特异性IgA+ PCs迁移至SILP。首先,作者发现在感染14天的派氏结中,IgA+ PCs高表达CXCR3。其次,Ifngr1缺陷的IgA+ PCs CXCR3表达显著降低。另外,CXCR3缺陷的IgA+ PCs在SILP中显著降低,但不影响骨髓中IgG+ PCs。
总之,这些数据表明TFH1细胞通过IFNγ上调IgA+ PCs细胞CXCR3表达,指导其迁移至SILP发挥肠道保护作用。
最后,作者试图揭示上述轮状病毒IgA+反应是否也适用于其他黏膜病毒。作者在小鼠中建立流感病毒(influenza A virus,IAV)感染模型并发现IAV感染在鼻黏膜、肺脏和骨髓诱导特异性IgA+和IgG+ PCs。然而,后续数据显示IAV特异性IgA+ PCs发育同样需要B细胞的抗原呈递和TFH1细胞参与。
不同的是,B细胞介导的抗原提呈并不足以诱导IgA+ LLPCs,还需要cDC细胞MHC-II介导的抗原提呈,提示不同黏膜位点病毒特异性的长寿命IgA反应需要独特的抗原提呈。
综上所述,这项研究不仅发现B细胞抗原提呈介导的TFH1细胞通过IFNγ-CXCR3指导长寿命IgA反应的新型免疫通路,更揭示不同黏膜位点对于长效保护性抗体产生的抗原提呈的差异,为未来疫苗设计和免疫治疗策略开辟了新的方向。
原文链接:
https://doi.org/10.1016/j.cell.2025.07.022
1. Deepta, Bhattacharya.(2022). Instructing durable humoral immunity for COVID-19 and other vaccinable diseases. Immunity, 55(6), 945-964. doi:10.1016/j.immuni.2022.05.004
2. Shane, Crotty.(2019). T Follicular Helper Cell Biology: A Decade of Discovery and Diseases. Immunity, 50(5), 1132-1148. doi:10.1016/j.immuni.2019.04.011
3. Xiangyun, Yin., Shuting, Chen., Stephanie C, Eisenbarth.(2021). Dendritic Cell Regulation of T Helper Cells. Annu Rev Immunol, 39(0), 759-790. doi:10.1146/annurev-immunol-101819-025146
4. David R, Fooksman., Zhixin, Jing., Rosa, Park.(2024). New insights into the ontogeny, diversity, maturation and survival of long-lived plasma cells. Nat Rev Immunol, 24(7), 461-470. doi:10.1038/s41577-024-00991-0
5. Joseph, Barbi., Steve, Oghumu., Claudio M, Lezama-Davila., Abhay R, Satoskar.(2007). IFN-gamma and STAT1 are required for efficient induction of CXC chemokine receptor 3 (CXCR3) on CD4+ but not CD8+ T cells. Blood, 110(6), 2215-6. doi:10.1182/blood-2007-03-081307
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


