《细胞》:卵巢癌面对免疫治疗“刀枪不入”的关键被找到了!
来源:奇点糕 2024-11-18 10:32
近日在《细胞》上,美国西奈山伊坎医学院研究团队发表的最新研究成果[1],首次揭示了卵巢癌抵御免疫治疗的关键机制:卵巢癌细胞可通过分泌IL-4,借助巨噬细胞构建免疫抑制性微环境,且癌细胞的这种调控是相对“短程”的,也解释了在异质性较强的肿瘤中,不同区域的免疫抑制性不尽相同,而针对IL-4信号进行干预则有望增敏卵巢癌免疫治疗。
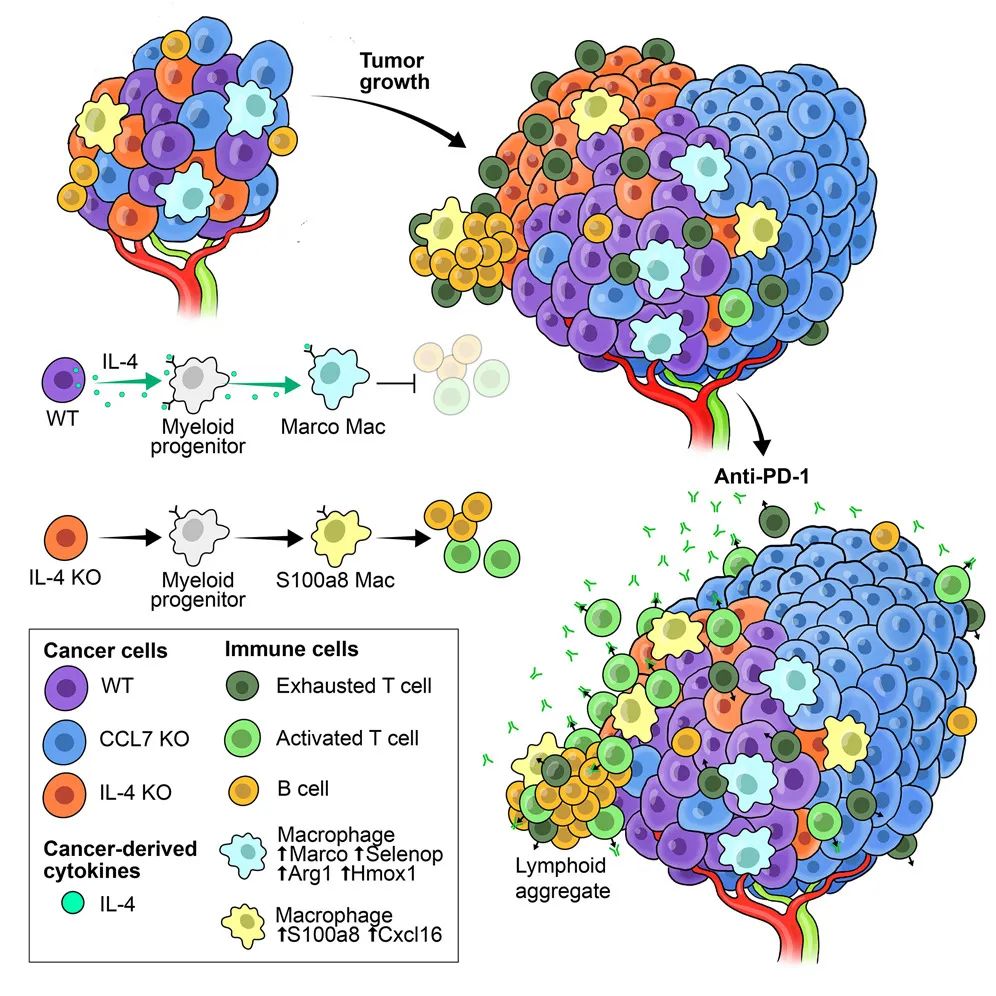
一图总结论文核心内容
为了突破既往研究分析卵巢癌异质性,以及细胞因子和趋化因子等外泌因子时的局限性,研究者们此次使用了名为Perturb-map的空间功能基因组学分析方法[2],评估一些可能参与癌细胞-巨噬细胞相互作用的基因(编码受体或配体)对卵巢癌肿瘤微环境的影响,并借助蛋白条形码CRISPR(PC/CRISPR)确认这些基因并不影响癌细胞本身,仅在胞外有作用。
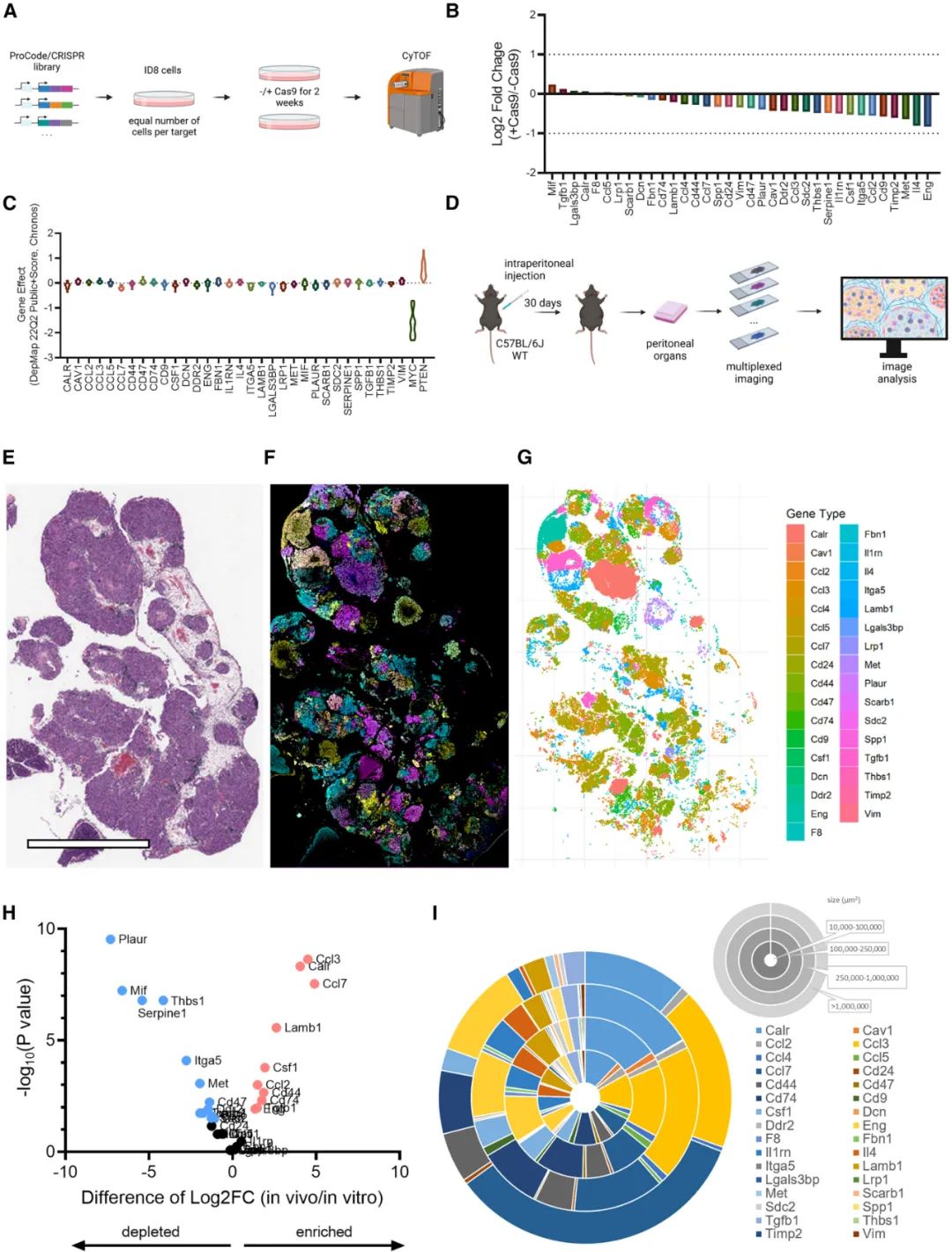
研究方法简要示意图
在筛选过程中,研究者们发现Plaur、Mif和Serpine1等基因缺失会显著抑制卵巢癌细胞增殖,而Ccl3、Calr和Ccl7等基因缺失则效果相反,其中编码趋化因子CCL7的Ccl7作用格外突出,而它主要的作用就是募集巨噬细胞;对比敲除Ccl7和正常的卵巢癌肿瘤微环境组分,研究者们发现敲除Ccl7营造出了免疫排斥型微环境,髓系细胞和CD4/CD8+T细胞等白细胞的浸润大幅下降,且内皮细胞也明显减少。

趋化因子CCL7对卵巢癌免疫微环境有重要影响
同时,Perturb-map上呈现的另一种现象也引起了研究者们的注意:虽然敲除Ccl7的肿瘤亚克隆在肿瘤中最多见,但周围总归还有不少未敲除的亚克隆,然而它们并不能旁分泌CCL7进行代偿性调控,甚至还有明显的竞争劣势,这才使卵巢癌的免疫微环境整体被敲除Ccl7所左右,也就是说不同亚克隆内癌细胞分泌细胞因子/趋化因子的调控作用范围很是有限。
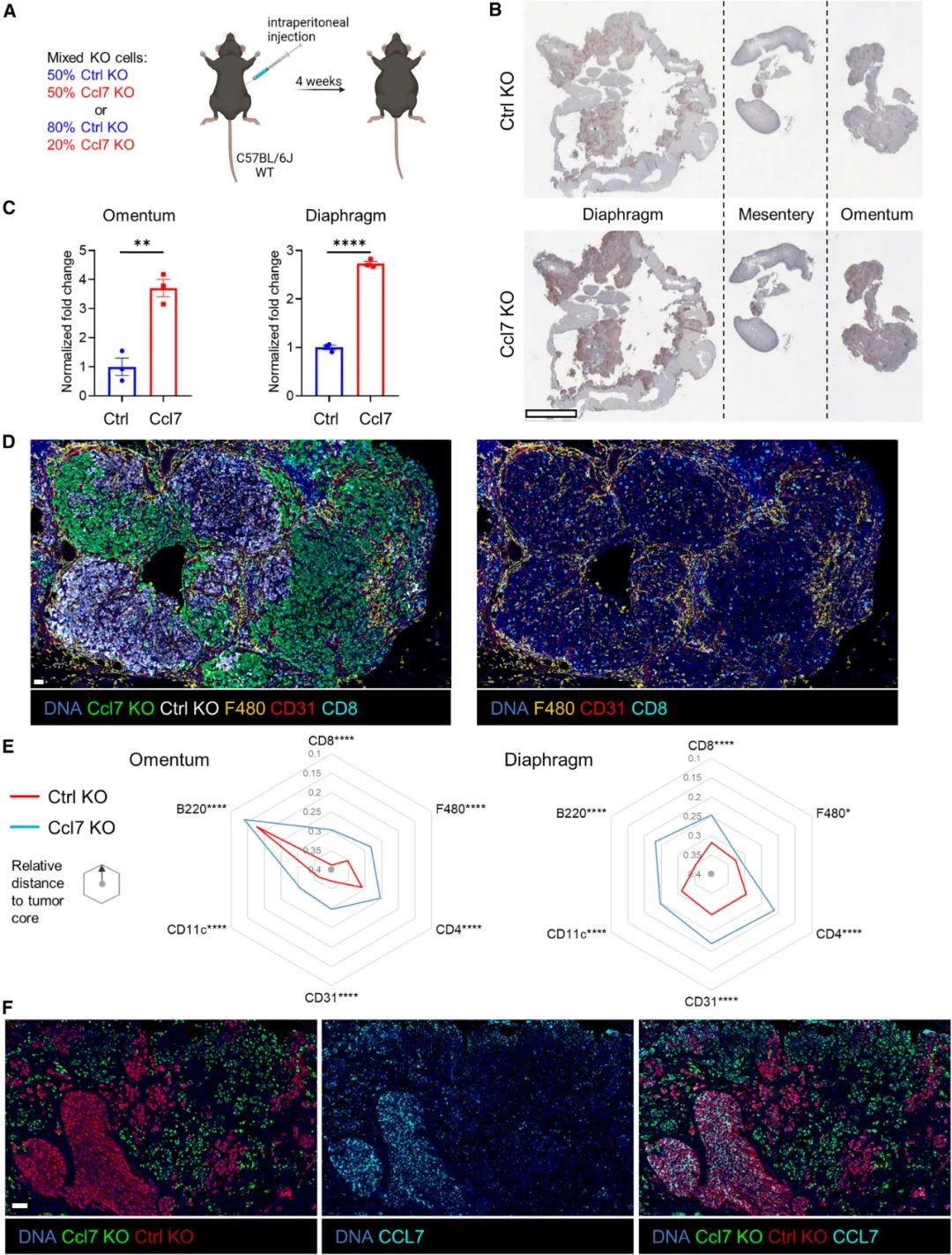
敲除部分癌细胞Ccl7的影响不能被周边亚克隆代偿,这与Ccl7敲除亚克隆的竞争优势有关
接下来,研究者们开始用PD-1抑制剂逐个处理敲除Ccl7等初筛基因的卵巢癌(在小鼠模型上),IL-4也就是在此时才浮出水面:相比敲除其它基因的波澜不惊、敲除Ccl7基因后的免疫耐药,仅有被敲除Il4的小鼠在免疫治疗后肿瘤负荷明显下降,意味着肿瘤对免疫治疗更敏感,但这个发现似乎有点反常识,因为既往研究从来都显示只有免疫细胞(如Th2细胞、嗜酸性粒细胞)能分泌IL-4,癌细胞它真有这功能吗?
鉴于单细胞RNA测序不能有效检测到Il4基因的转录本,研究者们特意用回了传统的RT-qPCR法,在卵巢癌细胞中检出了Il4 mRNA,并通过CRISPR敲入tdTomato荧光蛋白证实,卵巢癌中只有一小部分癌细胞具备产生IL-4的能力,这能够体现肿瘤异质性,但这一小部分癌细胞就是微环境中IL-4的主要来源,该过程会受到转录因子GATA6调控。
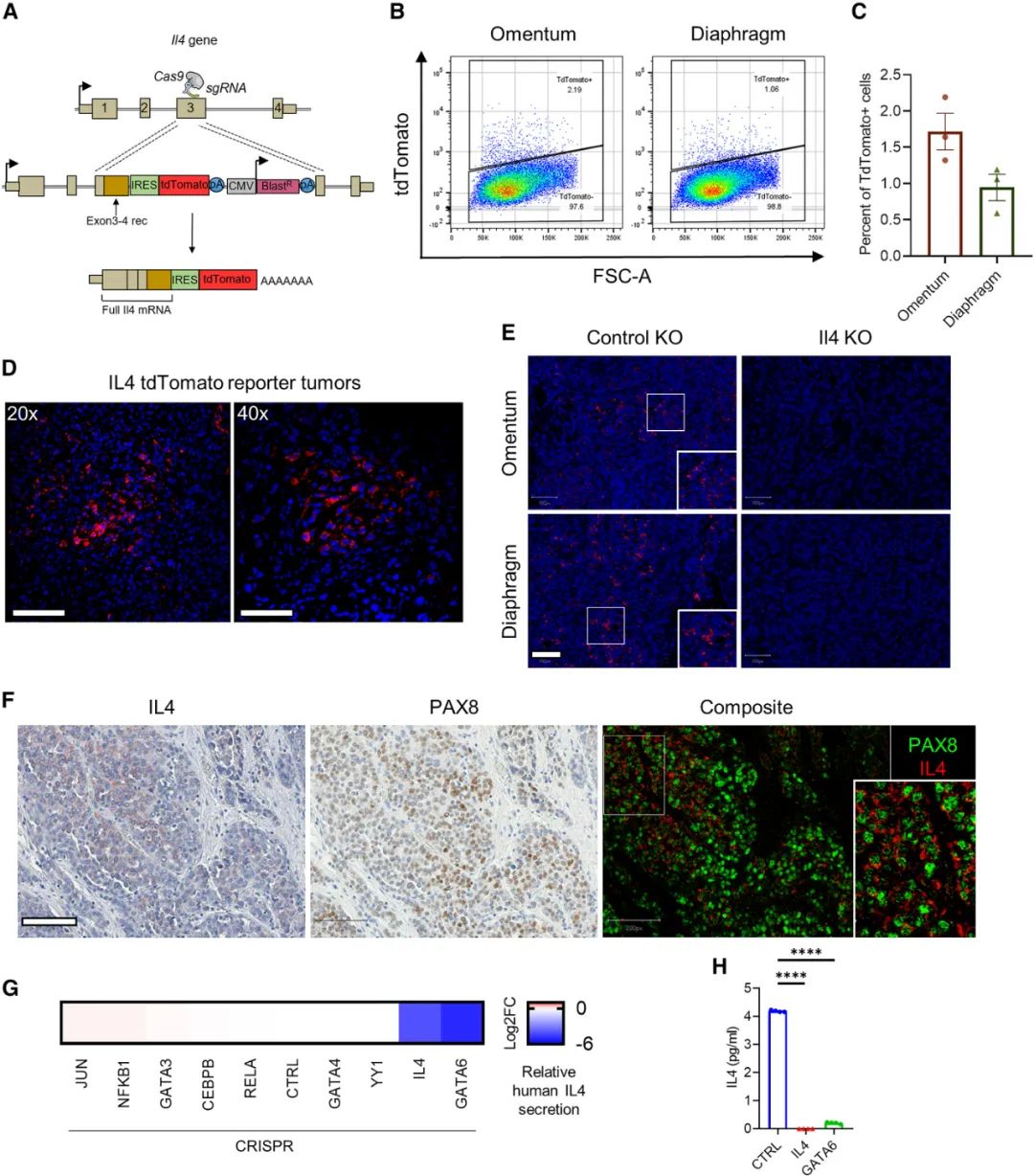
卵巢癌肿瘤微环境中的IL-4主要来自癌细胞
而这些IL-4也正是塑造卵巢癌免疫抑制性微环境的“关键少数”,它们主要作用于一部分巨噬细胞,再由巨噬细胞影响T细胞的募集和激活状态,因此针对IL-4信号进行干预就有望逆转免疫抑制,而研究者们使用的又是奇点糕提过的“老朋友”度普利尤单抗,它通过阻断IL4R受体,与免疫治疗成功实现了协同增效,看来它迟早能在癌症领域大显身手啊。
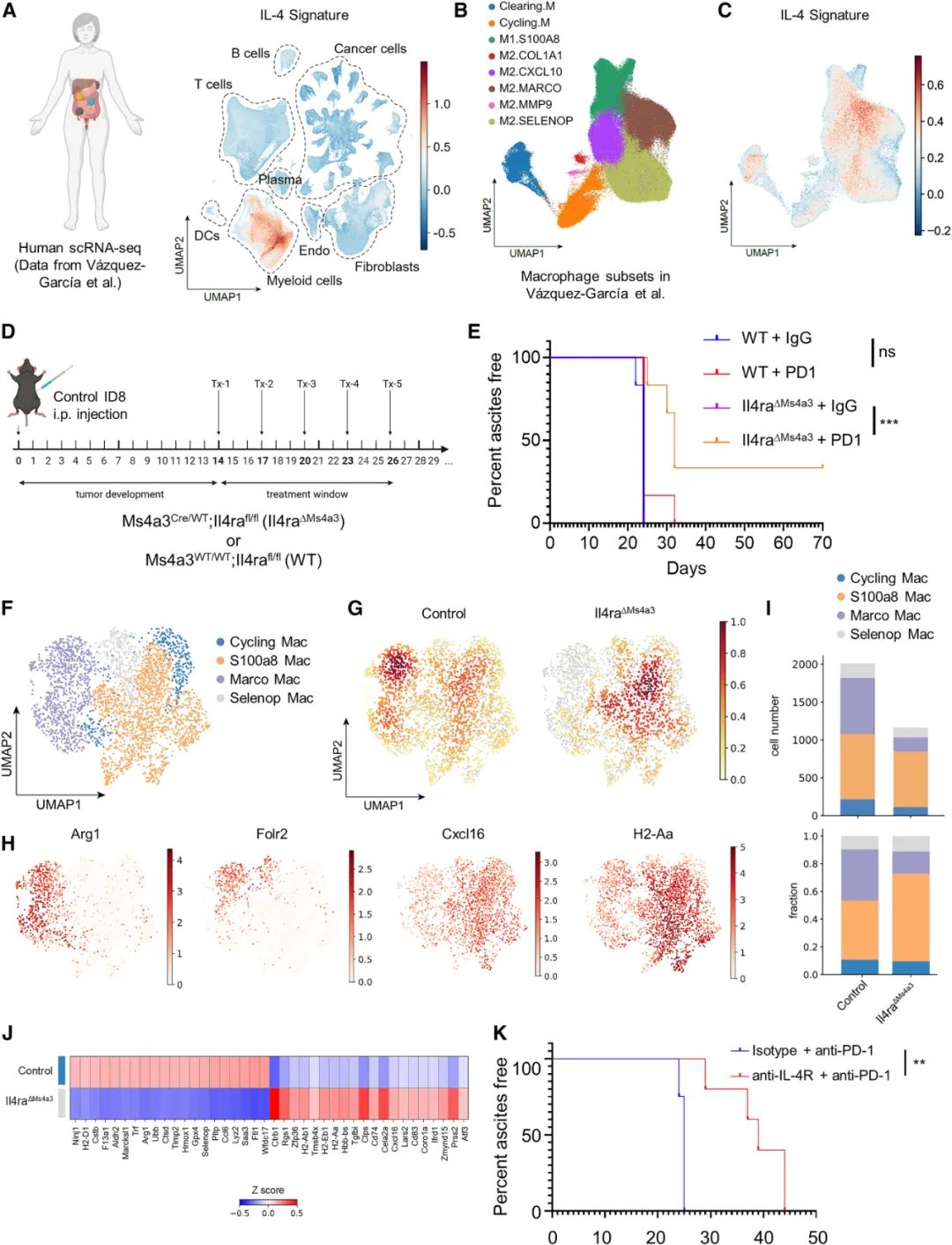
抑制IL-4R可与现有免疫治疗协同增效
参考文献:
[1]Mollaoglu G, Tepper A, Falcomatà C, et al. Ovarian cancer-derived IL-4 promotes immunotherapy resistance[J]. Cell, 2024.
[2]Dhainaut M, Rose S A, Akturk G, et al. Spatial CRISPR genomics identifies regulators of the tumor microenvironment[J]. Cell, 2022, 185(7): 1223-1239. e20.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


