蛋白激酶化学生物学研究获进展
来源:中国科学技术大学 2019-06-25 13:09
6月14日,中国科学技术大学姚雪彪团队与中国科学院生物化学与细胞生物学研究所张荣光合作团队在Cell Research 发表题为BubR1 phosphorylates CENP-E as a switch enabling the transition from lateral association to end-on capture of spindle microtubules
6月14日,中国科学技术大学姚雪彪团队与中国科学院生物化学与细胞生物学研究所张荣光合作团队在Cell Research 发表题为BubR1 phosphorylates CENP-E as a switch enabling the transition from lateral association to end-on capture of spindle microtubules 的论文,发现直接证据支持BubR1 是蛋白激酶,并解析了BubR1 蛋白激酶的构-效关联,发掘了首个BubR1 蛋白激酶抑制剂Bubristatin,为有关疾病的精准干预提供理论基础与平台技术。
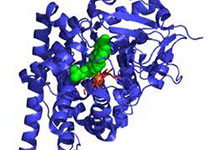
细胞是生命活动的最小单元,细胞器是真核细胞执行复杂生命活动调控的“工作室”。细胞器分为膜性细胞器与无膜细胞器。着丝粒是一个典型的无膜细胞器,其在细胞有丝分裂过程中扮演不可缺少的作用,其组装与功能异常导致染色体丢失、易位等,从而使细胞生长失控,如癌症。美国Bert Vogelstein团队在20世纪90年代发现了着丝粒BubR1基因突变对直肠癌基因组不稳定性的影响。此后, BubR1基因突变增加胃癌易感性的案例也相继报道。针对BubR1是否是蛋白激酶这一关键科学问题及其构-效关联的生物学意义,中国科大姚雪彪、滕脉坤、臧建业、刘行与生化与细胞所张荣光合作团队精诚合作,从2012年开始联手对有丝分裂重要蛋白激酶BubR1进行结构生物学研究。经过对多个物种BubR1蛋白在不同条件下的筛选与优化,成功地解析了果蝇BubR1蛋白的晶体结构(如图)。从X-线衍射数据分析得到的卡通模型结构表示:BubR1具有蛋白激酶的经典特征:一系列反平行β-折叠和一个α-螺旋形成的N端lobe;一个主要由螺旋结构组成的C端lobe。从晶体结构中研究人员分析得出两个lobe之间有个ATP的结合口袋。从激酶与构效研究结果提示,Lys1204、Asp1326和Ser1253这三个位点可与ATP形成氢键,对于稳定ATP与BubR1激酶区域结合口袋的结合非常重要,是BubR1催化底物磷酸化的结构基础(如图)。
由于同一种蛋白激酶在细胞活动的不同环节均有重要的功能,经典遗传学方法无法解剖其在时空两相较为紧密过程中的功能(如:染色体在赤道板上的排列与中心纺锤体的形成)。此外,由于一个蛋白激酶通常修饰多个底物,阐明其修饰底物的时空动力学特征及其与底物作用的特异性均需要可逆性细胞膜通透性化学探针。为此,刘行、汪志勇、阮科、张健存、杨振业与叶盛开始对BubR1激酶进行化学生物学研究。他们发掘了一个新型BubR1 激酶化学分子抑制剂Bubristatin。
利用Bubristatin 作为化学探针,他们系统评估了BubR1 激酶在有丝分裂的底物,发现马达蛋白CENP-E是BubR1的新底物。CENP-E 是一个在有丝分裂前中期定位在动点并参与染色体双向衔接及染色体运动的马达驱动蛋白,其功能缺失导致哺乳动物细胞中染色体排列缺陷、纺锤体检验点失活受阻等表型。鉴于BubR1 激酶与CENP-E在部分实体瘤的高活性表征,姚雪彪课题组开始把这些小分子与来自消化道肿瘤病人的类器官结合,实施个体化治疗的精准设计。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


