Science Translational Medicine:下调A20促进肺腺癌免疫逃逸
来源:本站原创 2021-07-13 16:03
炎症是众所周知的肺部肿瘤发生的驱动因素。肿瘤细胞逃避严格的体内平衡控制的一种策略是通过减少强大的抗炎蛋白肿瘤坏死因子α诱导蛋白3(TNFAIP3)的表达,也就是众所周知的A20。在肺癌患者和小鼠模型中,作者观察到肿瘤细胞A20的固有缺失显著促进了肺癌的发生,并与CD8+T细胞介导的免疫监视减少有关。在小鼠中,作者观察到这种效应完全依赖于细胞对干扰素- (IF
炎症是众所周知的肺部肿瘤发生的驱动因素。肿瘤细胞逃避严格的体内平衡控制的一种策略是通过减少强大的抗炎蛋白肿瘤坏死因子α诱导蛋白3(TNFAIP3)的表达,也就是众所周知的A20。在肺癌患者和小鼠模型中,作者观察到肿瘤细胞A20的固有缺失显著促进了肺癌的发生,并与CD8+T细胞介导的免疫监视减少有关。在小鼠中,作者观察到这种效应完全依赖于细胞对干扰素- (IFN-)信号的敏感性增加,通过异常激活罐结合激酶1 (TBK1)和下游信号转换器和转录激活因子1 (STAT1)的表达和激活增加。通过敲除干扰素-α/β受体来阻断这种自分泌前馈环路,完全恢复了细胞毒性T细胞的浸润,挽救了依赖肿瘤发生的A20的丢失。在STAT1下游,程序性死亡配体1(PD-L1)在A20基因敲除的肺肿瘤中高表达。因此,免疫检查点阻断(ICB)治疗对携带A20缺陷肺肿瘤的小鼠非常有效。此外,一个A20功能缺失基因表达特征与抗程序性细胞死亡蛋白1治疗的黑色素瘤患者的生存呈正相关。总之,作者确认A20是调节TBK1-STAT1-PD-L1轴的主要免疫检查点,可用于改善肺腺癌患者的ICB治疗。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34233950/
癌细胞表达免疫调节因子,重塑肿瘤微环境(TME),促进肿瘤免疫逃逸,这是癌症进展的标志。因此,打破肿瘤诱导的免疫耐受的TME靶向治疗目前正在进行中。用来逆转T细胞功能障碍的免疫检查点抑制剂的开发是一个重大进展,特别是在预后较差的恶性肿瘤中。对于肺癌患者,肺癌是癌症相关死亡的主要原因,免疫检查点阻断(Icb)的批准从根本上改变了治疗方案。然而,只有大约20%的非分层非小细胞肺癌(NSCLC)患者对针对程序性细胞死亡蛋白1(PD-1)/程序性死亡配体1(PD-L1)的单一疗法有反应,预测个别患者的反应仍然具有挑战性。需要更好地了解改变TME的因素,以避免使无反应者暴露于昂贵的ICB治疗方案的不必要毒性。
许多因素可能影响对icb的反应,包括突变负荷、肿瘤新抗原的存在、肿瘤或间质细胞中pd-l1的表达以及肿瘤浸润性免疫细胞的比例。启动和推动肿瘤进化的基因突变可以不同的方式调节TME的构成。这影响了ICB治疗的成败。例如,携带表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)重排的非小细胞肺癌患者以免疫治疗失败而臭名昭著。致炎、致癌的柯尔斯滕大鼠肉瘤病毒癌基因同源物(K-RAS)与其他癌基因或肿瘤抑制因子协同作用,使肿瘤细胞逃避免疫监视。此外,Myc的共同激活导致细胞毒性T细胞和自然杀伤(NK)细胞被排除在TME之外,并增加了巨噬细胞的浸润。丝氨酸/苏氨酸蛋白激酶(LKB1)是K-RAS驱动的肺腺癌(LUAD)中一种常见的灭活肿瘤抑制因子,其丢失导致干扰素(IFN)调控基因的表达减少,如T细胞趋化剂和PD-L1,这些基因与ICB耐药性相关。另一方面,一些p53突变可作为肿瘤新抗原,触发瘤内T细胞反应。
A20,也被称为肿瘤坏死因子α诱导蛋白3(TNFAIP3),是一种有效的抗炎酶,是炎症动态平衡的重要守门人。生化上,A20具有泛素编辑活性,其N端卵巢肿瘤结构域促进蛋白去泛素化,C端的锌指模体具有E3连接酶活性。这些特性使得A20能够去除关键的核因子B(NF-κB)信号成分中稳定的K63连接的多泛素链,进而促进K48连接的泛素化,而K48连接泛素化的靶向是这些蛋白的蛋白酶体降解。此外,A20与NF-κB必需调节物(NEMO)和受体相互作用的丝氨酸/苏氨酸激酶1(RIP1)通过非酶方式与多泛素链相互结合,从而抑制NF-κB(IκB)激酶亚单位的磷酸化,这是规范的NF-κB激活所必需的。A20还针对干扰素信号,转化生长因子β诱导的smad蛋白的激活,并抑制凋亡和自噬,至少在某些类型的细胞中是这样。
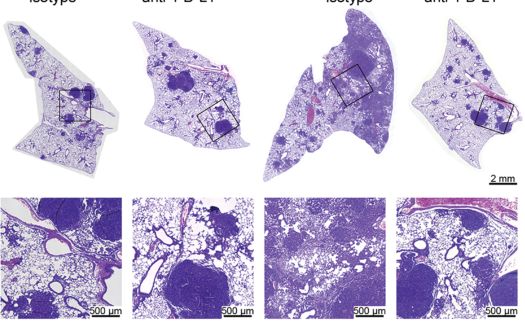
经指示抗体处理的KP和KPA小鼠在10周内的H&E染色肺切片
图片来源:https://pubmed.ncbi.nlm.nih.gov/34233950/
突出A20的生理作用,A20/TNFAIP3基因的各种多态性导致功能基因产物的表达减少,与炎症和自身免疫性疾病有关。关于癌症,A20的作用仍然存在争议,因为A20可能致癌或抑制肿瘤,这取决于来源的组织。在这项工作中,作者发现了非小细胞肺癌中A20的一个功能。作者的数据表明,肿瘤固有的A20下调或缺失通过促进肿瘤免疫逃逸来促进LUAD的生长,这种方式依赖于坦克结合激酶1(TBK1)信号转导和转录激活因子1(STAT1)-PD-L1。因此,A20是一个有效的免疫检查点,其肿瘤内源性表达可能影响LUAD抗PD-L1治疗的结果。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



