《自然·生物技术》:肠癌靶向型抗生素治疗诞生!科学家研发新型抑癌抗生素,靶向杀伤促结直肠癌细菌,“交叉免疫”激活T细胞
来源:奇点糕 2023-09-27 13:29
要知道,肠癌免疫治疗此前收效不佳,正是因为肠癌大多为微卫星稳定型(MSS)肿瘤,缺少可被免疫系统识别的新抗原,所以北卡团队此次的研究还真是急临床之所急。
在Nature Biotechnology上,北卡罗来纳大学团队发表的最新研究成果正是如此:用专门设计的脂质体抗生素(核心成分为替硝唑),杀伤与结直肠癌(CRC)发生发展高度相关的特定细菌,就可以借助“交叉免疫”激活T细胞,让它们把癌细胞和细菌一网打尽,且这种干预策略也不会使肠道菌群失调[1]。

论文首页截图
几年前就有登上《自然》和《科学》的重磅研究显示,微生物(细菌或噬菌体)来源的人类白细胞抗原(HLA)分子,也会出现在癌细胞表面,且能够被本职工作是抗癌的T细胞所识别,意味着微生物和癌症之间存在“交叉免疫”[2-3]。
北卡团队由此推测,杀灭肿瘤内的微生物,有可能使更多微生物和癌细胞共享的抗原表位被暴露,更好地激活免疫应答,这种思路其实和免疫治疗联合放疗、化疗比较相似,其它手段造成杀伤后释放的抗原,就能增敏免疫治疗。
不过要达成精准杀灭肿瘤内微生物的目标,靠传统广谱抗生素显然不行,需要的是精准给药、强效打击,为此研究团队开发了名为LipoAgTNZ的新型抗生素,它的核心成分是银-替硝唑复合物,并由纳米脂质体包裹,以精准递送到肿瘤部位。
之所以选择替硝唑,就得从研究团队锁定微生物“嫌疑人”的过程说起了:研究团队首先分析了3.6万余例接受手术的肠癌患者资料,发现手术前患者使用过针对厌氧微生物的抗生素(替硝唑等硝基咪唑类药物或林可霉素),与术后肿瘤复发或死亡风险降低25.5%相关,这和肠癌标准辅助化疗都有得一拼。

针对厌氧微生物的抗生素,对肠癌患者存在“保护效应”
进一步实验和分析显示,在乏氧条件下“入侵”肠癌内部的细菌主要是具核梭杆菌(F. nucleatum),它们能使肠癌在小鼠身上的生长速度暴增30倍(对比缺少该菌的小鼠),且同时存在于原发肿瘤、淋巴结侵犯和远处转移灶中,它们显然是要重点打击的对象,那么就该轮到LipoAgTNZ出手了。
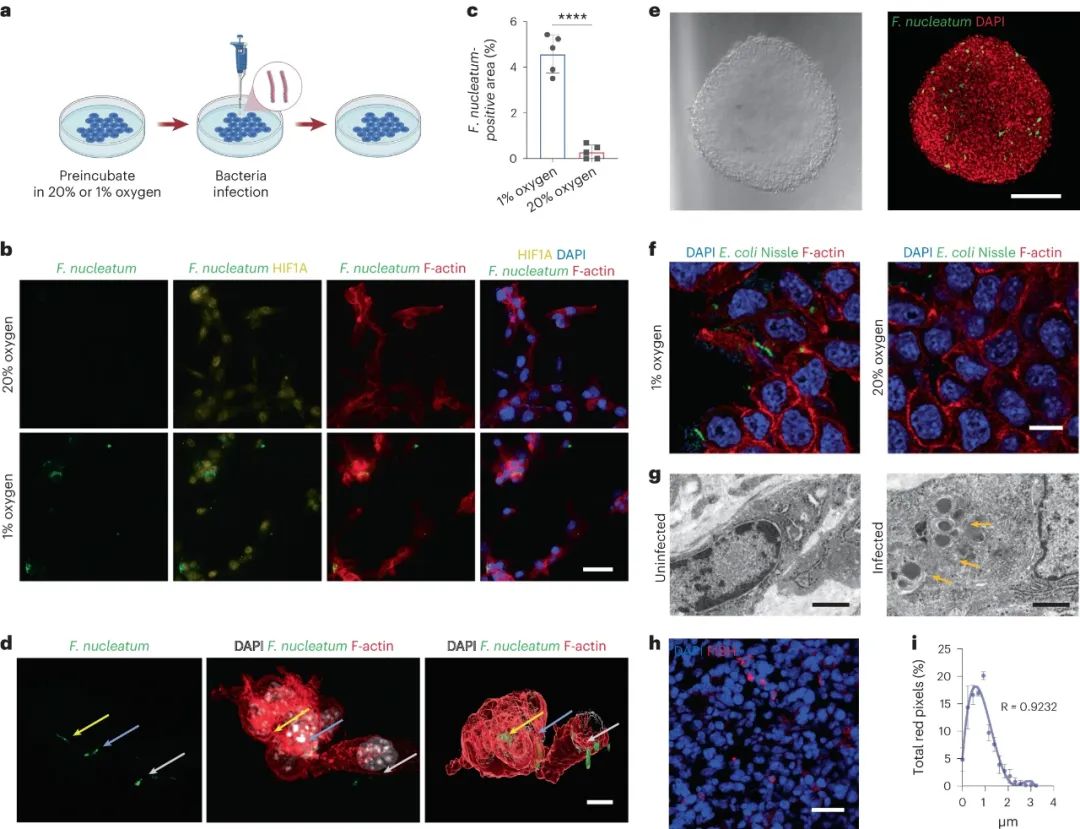
肠癌内的具核梭杆菌对肿瘤发生发展或意义重大
研究团队对肠癌模型小鼠(已感染具核梭杆菌)使用LipoAgTNZ治疗,不仅能迅速清除具核梭杆菌及大肠埃希菌(E. coli Nissle)等定植微生物,还使小鼠长期存活率达到71%,远高于对照组,且这种效应与肠道内具核梭杆菌无关。
而LipoAgTNZ杀灭微生物并激活免疫应答的假说,也同时得到了证实:肠癌内浸润的CD3+/CD8+T细胞及CD44+CD62+记忆T细胞均显著增多,它们还能抵抗住肿瘤再挑战,而不利于抗肿瘤免疫的M2型肿瘤相关巨噬细胞则明显减少;如提前清除掉小鼠体内的CD4+/CD8+T细胞,LipoAgTNZ的功效也就不存在了。
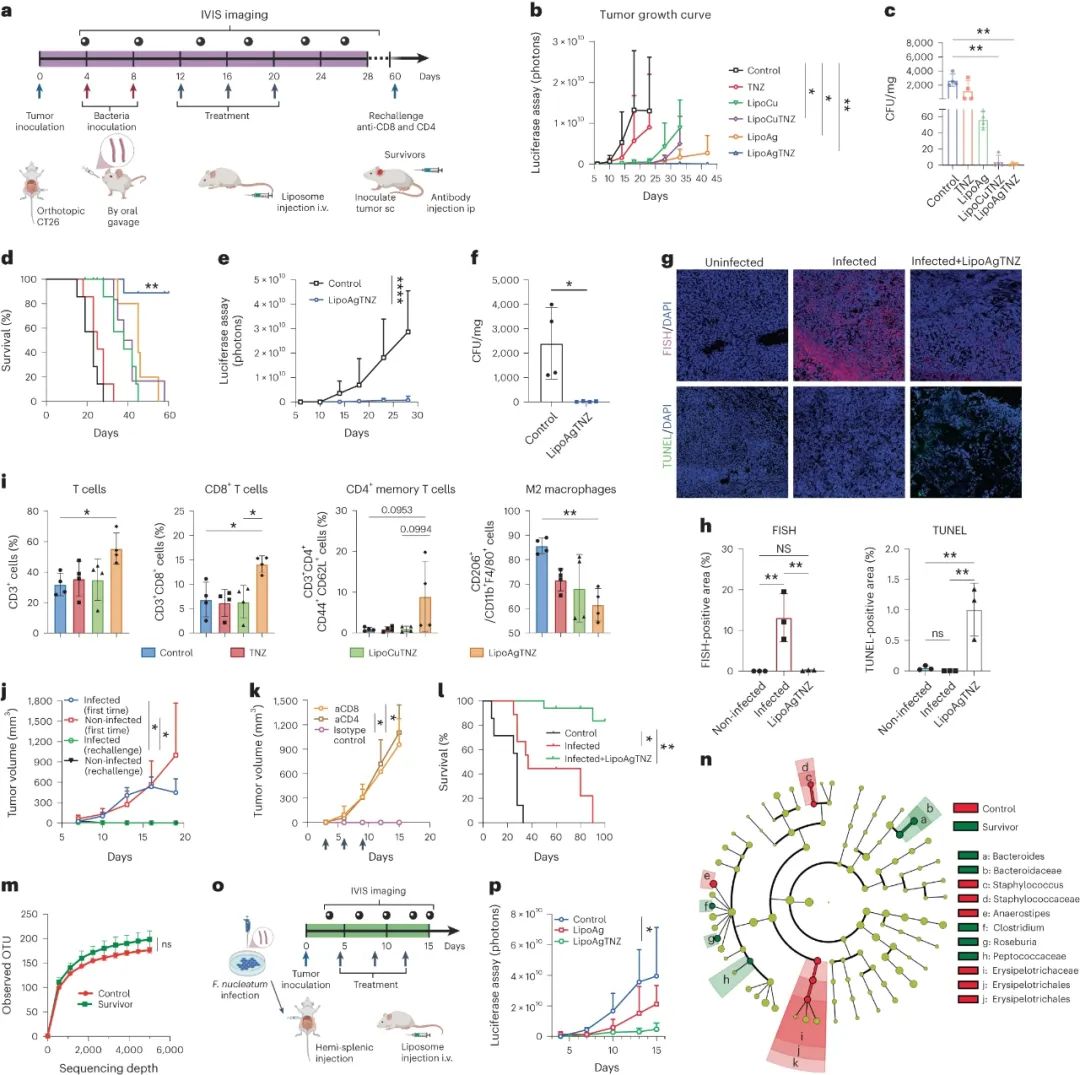
LipoAgTNZ治疗可改善肠癌模型小鼠生存率,且肿瘤浸润免疫细胞增多
对肠癌最常见的远处转移——肝转移,LipoAgTNZ也能通过清除定植微生物,起到相似的抑癌作用。研究团队还专门拿临床常规治疗具核梭杆菌感染的抗生素联合疗法(硝基咪唑类药物+头孢菌素)做实验,发现联合治疗会使肠道菌群失调,进而影响免疫应答,而LipoAgTNZ治疗不会破坏肠道菌群稳态。
最后,研究团队分析了LipoAgTNZ杀伤具核梭杆菌,进而激活免疫应答的全过程,证实了“交叉免疫”激活T细胞的假说:经LipoAgTNZ处理被激活的CD8+T细胞,确实有相当一部分能识别具核梭杆菌来源的抗原肽(由HLA-I类1分子呈递),其中就有细菌与肠癌共享的抗原肽,所以T细胞才能来个一网打尽。
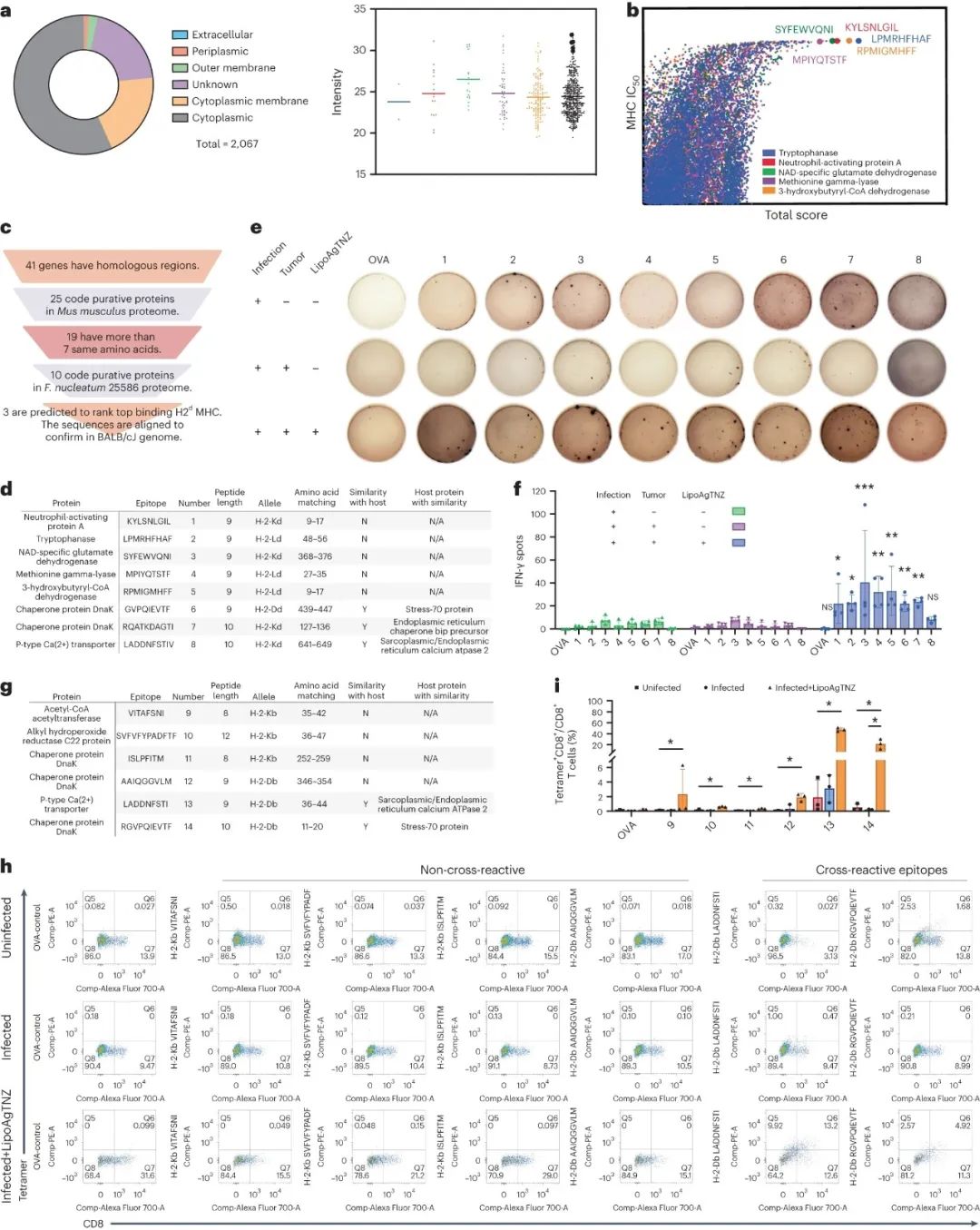
LipoAgTNZ杀伤具核梭杆菌,释放了可被T细胞识别的细菌来源新抗原
要知道,肠癌免疫治疗此前收效不佳,正是因为肠癌大多为微卫星稳定型(MSS)肿瘤,缺少可被免疫系统识别的新抗原,所以北卡团队此次的研究还真是急临床之所急。杀灭微生物就能让冷肿瘤变热肿瘤,这路子未来可很有前景啊。
参考文献:
[1]Wang M, Rousseau B, Qiu K, et al. Killing tumor-associated bacteria with a liposomal antibiotic generates neoantigens that induce anti-tumor immune responses[J]. Nature Biotechnology, 2023.
[2]Kalaora S, Nagler A, Nejman D, et al. Identification of bacteria-derived HLA-bound peptides in melanoma[J]. Nature, 2021, 592(7852): 138-143.
[3]Fluckiger A, Daillere R, Sassi M, et al. Cross-reactivity between tumor MHC class I–restricted antigens and an enterococcal bacteriophage[J]. Science, 2020, 369(6506): 936-942.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


