Science:解析出两种帕金森病相关蛋白结合在一起时的三维结构
来源:生物谷原创 2024-01-12 09:52
蛋白LRRK2和Rab29是两种与晚发性帕金森病有关的蛋白。LRRK2是一种蛋白激酶,它能在一种叫做磷酸化的过程中修饰其它蛋白。Rab29是Rab GTP酶家族的成员,它能调节细胞转运,并能调节LRR
蛋白LRRK2和Rab29是两种与晚发性帕金森病有关的蛋白。LRRK2是一种蛋白激酶,它能在一种叫做磷酸化的过程中修饰其它蛋白。Rab29是Rab GTP酶家族的成员,它能调节细胞转运,并能调节LRRK2的活性。
目前还不清楚Rab29和LRRK2是如何协同作用导致帕金森病的。在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员揭示了LRRK2和Rab29的复杂结构。他们确定了LRRK2与Rab29结合在一起时的结构,揭开了LRRK2调控背后的奥秘,并提出了对药物设计有意义的见解。相关研究结果发表在2023年12月22日的Science期刊上,论文标题为“Rab29-dependent asymmetrical activation of leucine-rich repeat kinase 2”。

帕金森病是仅次于阿尔茨海默病的第二大常见神经退行性疾病,65岁以上的老年人口中有1%~2%的人患有该病。众所周知,帕金森病与遗传有关,约15%的病例有家族史。虽然与该疾病相关的基因有很多,但 LRRK2 基因突变是最常见的原因之一。由于 LRRK2 体积庞大,对其进行结构研究非常麻烦。
论文通讯作者、圣犹大儿童研究医院结构生物学系的Ji Sun博士说,“对这种蛋白的研究极具挑战性。”
尽管困难重重,Sun和他的团队还是于 2021 年在Cell期刊上首次发表了全长 LRRK2 的结构(Cell, 2021, doi:10.1016/j.cell.2021.05.004)。Sun解释说,“在这篇Cell论文中,我们得到了LRRK2的结构,但该结构显示出一种非活性构象。”蛋白通常有活性和非活性两种形式,受不同的细胞信号调控。有时,它需要与另一种蛋白结合才能引发结构变化,从而使它从非活性形态转变为活性形态。“于是我们开始思考:我们获得了 LRRK2 的一种关键状态。我们能得到它的活性构象吗?”
低温电镜捕捉 LRRK2 的活性状态
寻找活性构象并不像将 Rab29 添加到 LRRK2 中那么简单。LRRK2 可以与其他 LRRK2 分子结合,这一过程被称为寡聚化。这可以将单个 LRRK2 单体变成二聚体,甚至更大的组合体。这意味着这些作者必须寻找代表LRRK2活性形式的版本。还有一个问题是,Rab29 位于细胞膜上。
Sun解释说,“在细胞中,约90%或更多的LRRK2位于细胞质。极少量位于细胞膜表面,形成大的寡聚体。这些寡聚体就是具有活性和功能的版本。”
包括论文第一作者、圣犹大儿童研究医院结构生物学系博士Hanwen Zhu在内,这些作者利用低温电镜首次确定了Rab29-LRRK2复合物的结构,其中包括LRRK2单体和二聚体的结构,以及一个意想不到的四聚体的结构。
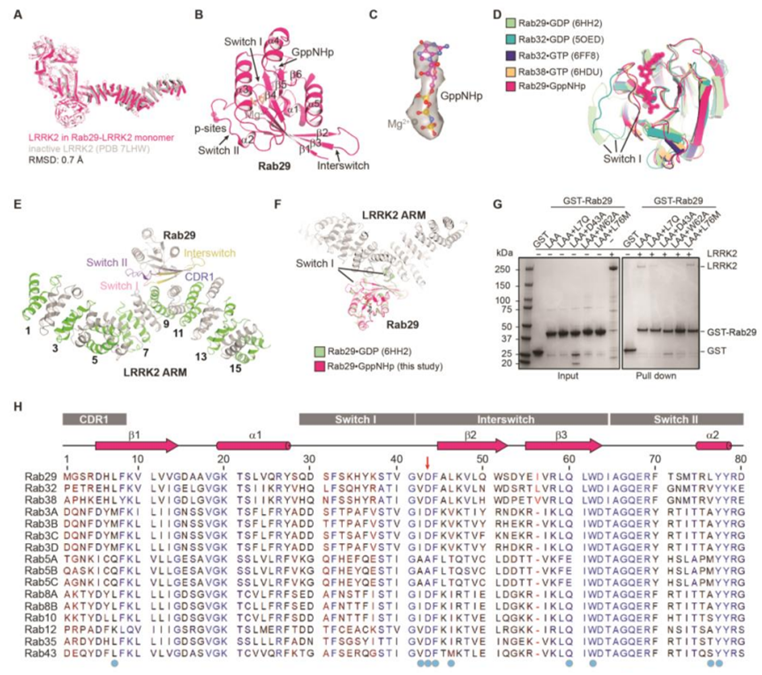
图片来自Science, 2023, doi:10.1126/science.adi9926。
Sun说,“在这个四聚体中,我们看到了LRRK2的活性构象,但在单体和二聚体复合物中,LRRK2处于非活性构象。”
了解Rab29-LRRK2复合物
这些发现表明,LRRK2的激活不仅取决于与它相互作用的蛋白,还取决于它们在细胞内的空间排列。
Sun 解释说,“我们提出了细胞膜招募后LRRK2从单体到四聚体的转变。在细胞内,LRRK2大多是无活性的单体或二聚体。但当 Rab29 将 LRRK2 募集到细胞膜上时,LRRK2 的局部浓度就会增加。这就促进了LRRK2向四聚体的转变,从而使LRRK2变得活跃起来。”
这些发现对帕金森病有什么影响呢?这些结构为科学家们提供了原子尺度的结构图,用来追踪导致帕金森病的不同突变如何影响这种Rab29-LRRK2的功能。
Sun说,“所有这些突变实际上都有利于活性构象,这意味着它们在活性构象中提供了新的相互作用,或者破坏了非活性构象中的相互作用,在我们的结构中,突变的影响可以被很好地可视化观察;它得到了很好的解释。”
这类结构研究的重要性不仅在于所获得的型见解,还在于它们在药物设计中的潜在应用。例如,这些作者还捕捉到了药物 DNL201 存在时 LRRK2 的结构。这种药物经过了1期临床试验,能将这种蛋白锁定在活性状态,因此他们利用这一点来验证他们的发现,即四聚体确实是这种复合物的活性形式。
Sun 解释说,“我们如今有了非活性构象和活性构象,因此可以监测从非活性状态到活性状态的转变。这些结构为药物化学家设计治疗帕金森病的新型 LRRK2 抑制剂提供了急需的见解。”(生物谷 Bioon.com)
参考资料:
Hanwen Zhu et al. Rab29-dependent asymmetrical activation of leucine-rich repeat kinase 2. Science, 2023, doi:10.1126/science.adi9926.
Structures of Parkinson's disease-linked proteins offer a framework for understanding how they work together
https://medicalxpress.com/news/2023-12-parkinson-disease-linked-proteins-framework.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


