世界首例“人造血液”临床试验,源自2017年Nature子刊论文,或将彻底改变血液疾病的治疗
来源:生物世界 2022-11-15 18:15
血液是生命的源泉,是人体不可或缺的运输载体,能调节各组织器官的生理活动。当人体失血过多时,各组织器官处在缺血缺氧的状态,机体内环境发生紊乱,无法维持正常的生理功能,失血者就会有生命危险。
血液是生命的源泉,是人体不可或缺的运输载体,能调节各组织器官的生理活动。当人体失血过多时,各组织器官处在缺血缺氧的状态,机体内环境发生紊乱,无法维持正常的生理功能,失血者就会有生命危险。
对于大量失血病人,输血是目前临床上最常用和最有效的措施,而这些血液主要来源于无偿献血。但过度依赖无偿献血容易造成“血荒”,即血库供血量严重不足,尤其是在学生放假的寒暑期。此外,对于稀有血型失血者,很难从血库中找到与之匹配的血液。
为了解决这些“血荒”问题,近日,英国NHS血液与移植中心、布里斯托大学、剑桥大学等机构合作,开展了世界上第一个人造红细胞的临床试验。这些红细胞完全是在实验室里培育出来的。研究团队从约470ml健康人捐献的血液中分离出50万个干细胞,在此基础上培养出500亿个红细胞,最终筛选出约150亿个成长到适合输入人体的红细胞。
这项临床试验是建立在2017年发表在 Nature Communications 的一篇论文的基础上【1】。该研究从成体干细胞培养出永生化人类成体红细胞系(BEL-A),其可以持续增殖,这些永生化细胞系可以在实验室培养并有效分化为成熟的、有功能的红细胞。而且这些永生化细胞系分化而来的成熟红细胞与体外培养的红细胞在功能上和分子水平上没有发现差异,重要的是,没有异常的蛋白表达。
这项研究证明了从体外培养制造用于临床的红细胞的可行性。

2022年11月7日,英国国民保健制度(NHS)网站发布声明称,已经有两名志愿者接受“人造红细胞”输血,输入量在5至10ml之间。这些人造红细胞经过标记,输入人体后仍能被研究人员追踪。令人鼓舞的是,这两名志愿者目前未出现任何副作用。
研究团队表示,之后还将有另外至少8名志愿者参与这项试验。所有志愿者将间隔至少4个月接受两次少量红细胞输入:一次为人造红细胞,另外一次为普通红细胞。
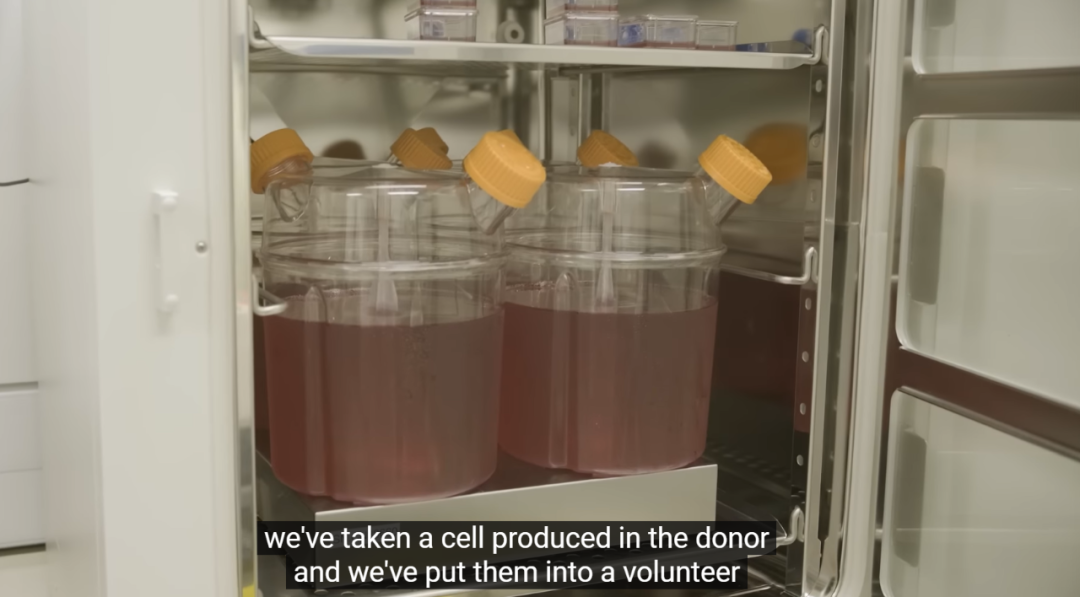
在实验室中培育“人造红细胞”
如果这项临床试验被证明是安全有效的,这些“人造红细胞”将在镰状细胞病、造血障碍和稀有血型失血等血液疾病的治疗中大展身手。事实上,目前对于患有这些血液疾病的人来说,很难找到足够匹配的献血。
对于这项临床试验,镰状细胞学会的首席执行官 John James OBE 表示,这项研究为那些难以输血的镰状细胞患者带来了真正的希望,他们对大多数供体血型都会产生抗体。
除此之外,人造红细胞直接由干细胞培育而来,是“新鲜出炉”的,相比之下,从献血者中获得的红细胞有“新”有“旧”。这意味着,人造红细胞输血将维持更久的时间,相同时间内患者需要输血的次数更少。这将减少频繁输血导致的铁超载,后者可能导致严重的并发症。
现阶段人造红细胞投入临床应用仍要面临许多挑战。首先,人造红细胞产量少,因此在未来很长一段时间里,血库主要来源还是血液捐献;其次,人造红细胞造价高昂,比普通输血的费用高得多,其主要目标还是为一些有特殊用血需要的患者提供人造血液。
总而言之,这项世界领先的临床试验为制造人造红细胞奠定了基础,这些人造红细胞可以安全地用于镰状细胞病等血液疾病患者输血。虽然目前绝大多数血液需求仍依赖于献血,但毫无疑问,这项工作为难以输血的患者带来的新的希望。
值得一提的是,上述研究团队于2018年4月在 EMBO Molecular Medicine 期刊发表了一篇题为:Enhancement of red blood cell transfusion compatibility using CRISPR-mediated erythroblast gene editing 的研究论文【2】。
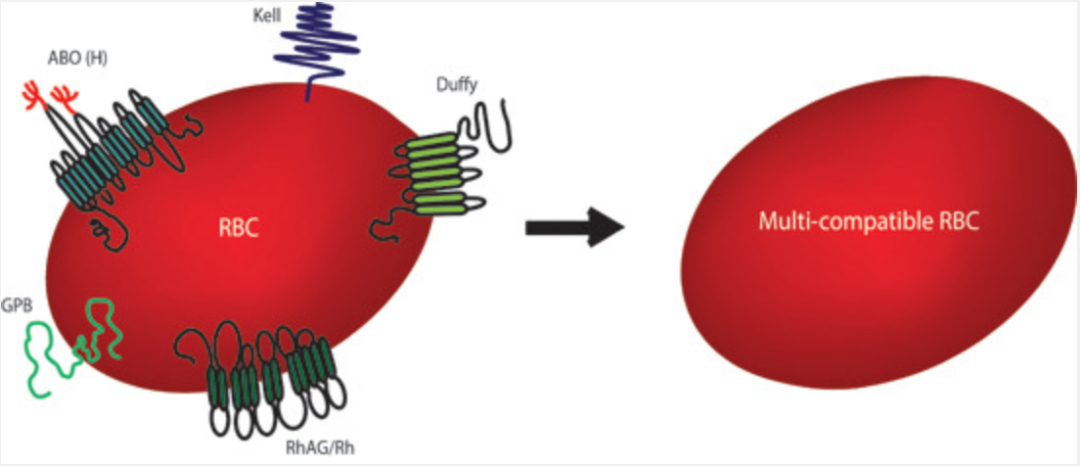
该研究更进一步,通过CRISPR-Cas9基因编辑了之前开发的永生化人体成体红细胞系(BEL-A),增强其输血相容性。为长期输血的患者的同种免疫以及“熊猫血”输血时难以匹配血型的难题带来了新的解决方法。

研究团队使用 CRISPR-Cas9 基因编辑技术敲除了永生化人类成体红细胞系(BEL-A)的5个与血型相关的基因——FUT1、ACKR1、KEL、GYPB、RHAG,这5个基因编码了最常见的输血不相容性抗原。
敲除这5个基因后,这些永生化人类成体红细胞系(BEL-A)分化而来的成熟红细胞将可以给多种血型的人输血,而不必担心发生血液凝集。
而在2019年6月,加拿大不列颠哥伦比亚大学的研究人员在 Nature Microbiology 期刊发表了题为:An enzymatic pathway in the human gut microbiome that converts A to universal O type blood 的研究论文。
该研究发现了存在于人体肠道中的微生物产生的两种酶,只需加入极低浓度,就可以成功地将A型血转换成万能的O型血。这一发现有望改变目前血液供应不足的现状。

决定血型的红细胞抗原,是糖脂分子,而人类肠道种的微生物群可以通过酶促反应分解各种糖蛋白,这些糖蛋白种的糖跟红细胞抗原类似。因此研究团队决定在人类肠道细菌中寻找更好可以去除红细胞抗原A的酶。他们通过收集人粪便样本,并分离出DNA,理论上这些DNA中包括编码消化糖蛋白的细菌酶的基因。然后,将这些DNA切碎并将不同的DNA片段转染到大肠杆菌中,监测是否有任何大肠杆菌随后产生具有去除抗原A的能力的蛋白质。
他们最终发现了一种名为 Flavonifractor plautii 的肠道细菌,它产生的两种酶,可以成功去除血液中的红细胞抗原A,从而可以将A型血转变为O型血。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


