《自然·医学》:破解脑转移癌细胞对放疗耐药之谜
来源: 奇点糕 2022-04-29 11:15
Valiente团队发现了S100A9介导了脑转移癌的放疗抵抗,且可作为潜在的生物标志物预测患者对放疗的敏感性,从而达到个性化治疗的目的。
全脑放射治疗(WBRT)一直是脑转移癌的主要治疗手段之一,尤其是对那些没有手术机会的患者[1]。但很遗憾的是,目前的临床证据显示全脑放疗并不能显著改善脑转移癌患者的预后[2]。
因此,探究脑转移癌对放疗抵抗的分子机制,以及寻找可预测放疗敏感性的分子标志物,将有助于寻找解决放射治疗抵抗的方法,以及患者个性化放疗方案的制定。
近日,来自西班牙国家癌症研究中心的Manuel Valiente教授团队发现了脑转移癌对全脑放疗抵抗的新机制。
他们发现脑转移癌细胞可高表达并分泌S100A9蛋白,通过与肿瘤细胞表面的受体RAGE相结合,激活细胞内NF-κB/JunB信号通路而介导放疗抵抗作用,这种放疗抵抗作用可被RAGE抑制剂FPS-ZM1所逆转。
此外,他们还发现S100A9可作为生物标志物(血液检测或肿瘤组织检测均可),用来预测脑转移瘤患者对全脑放疗敏感性,从而对患者进行个性化放射治疗。
该研究结果为脑转移患者进行个性化放射治疗提供了理论基础,同时发现了一种具有潜在临床应用价值的放射增敏剂,具有十分重要的临床转化意义,相关研究结果发表于著名期刊《自然·医学》上[3]。

文章首页截图
为了研究脑转移癌(BrM)对全脑放疗抵抗的机制,Manuel Valiente教授团队首先构建了肺癌脑转移动物模型(肺腺癌细胞系H2030-BRM心内接种)和乳腺癌脑转移动物模型(TNBC细胞系E0771-BRM颅内接种)。
他们发现,与对照组相比,三种不同方案的全脑放疗均未能延长小鼠生存期,而奇怪的是,这两个细胞系在体外培养时却对放疗十分敏感。
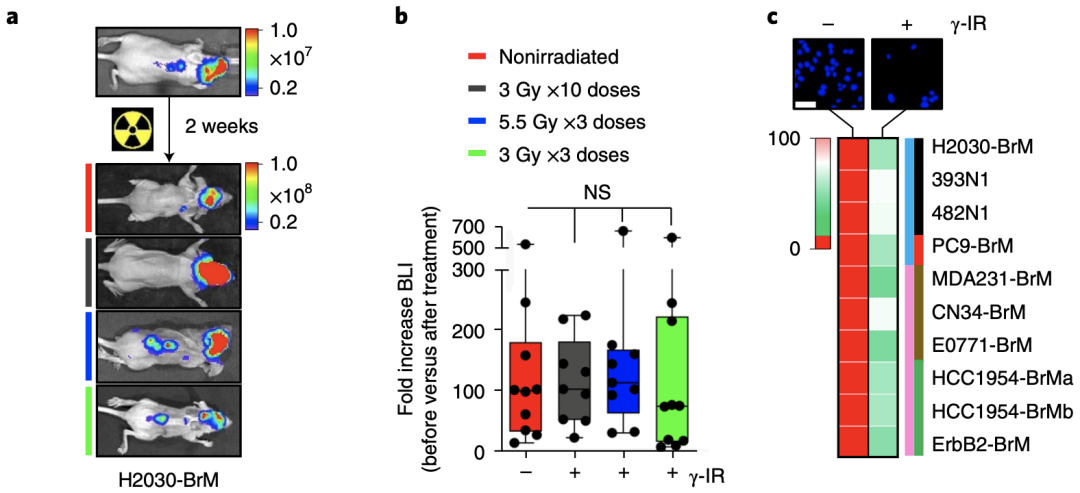
脑转移癌动物模型对全脑放疗抵抗,但细胞系在体外培养时却对放疗十分敏感
这一有趣的现象使得研究人员猜想,是否是因为肿瘤细胞与脑组织接触而变得对放疗抵抗呢?
于是他们将H2030-BRM或E0771-BRM细胞放置在体外培养的脑组织薄片上,并对它们进行与之前相同的放射处理,结果发现癌细胞果然变得对放疗抵抗,这表明肿瘤生长的脑部微环境中具有改变细胞放疗敏感性的物质存在。
此前曾有研究发现,脑转移癌细胞与神经胶质细胞的相互作用,对脑转移癌细胞的生长起着重要作用[4]。研究人员将脑转移癌细胞和胶质细胞共培养后发现,只有当脑转移癌细胞与胶质细胞直接接触(将两种细胞分隔培养无效),特别是与星形胶质细胞相接触,才会出现对放疗的抵抗。
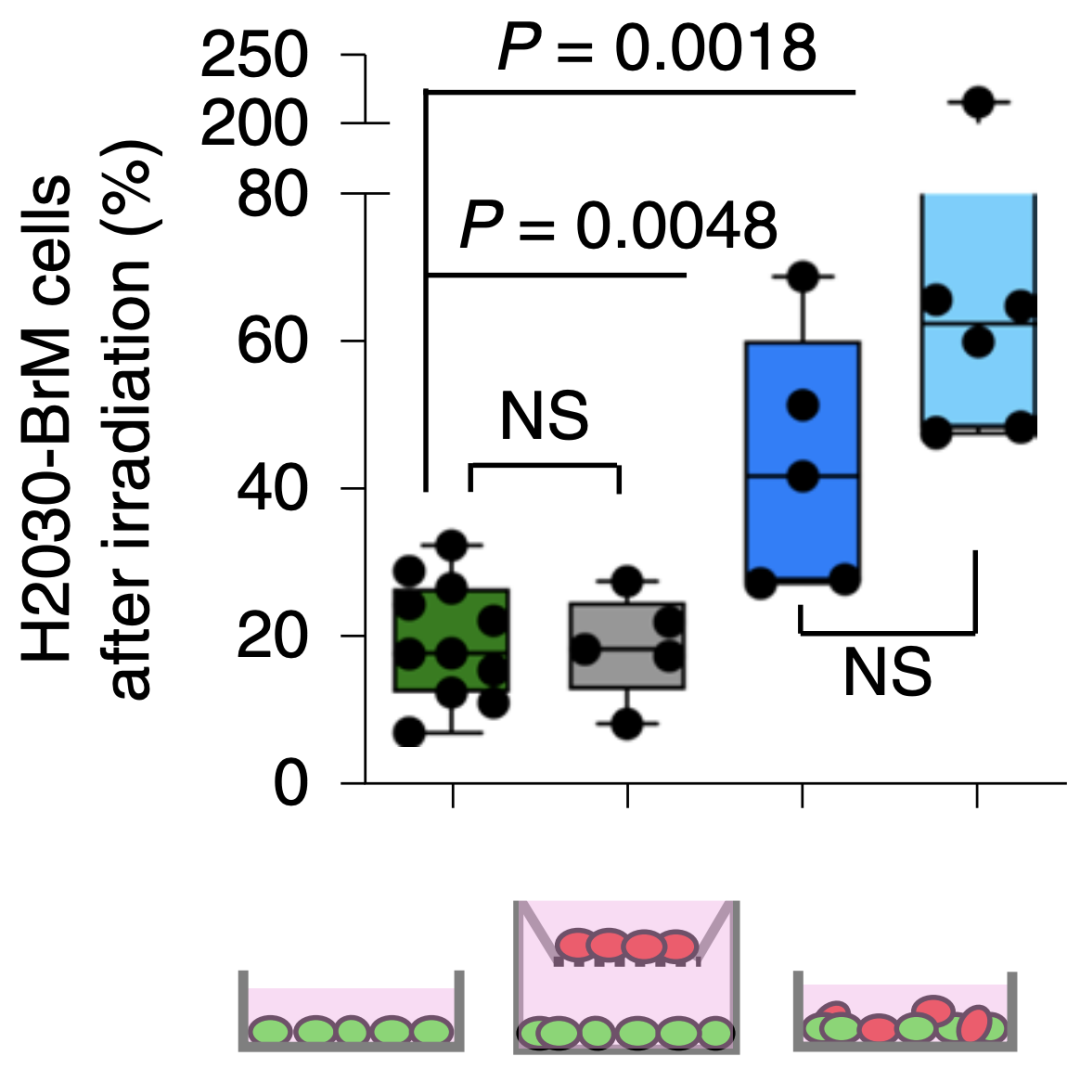
脑转移癌细胞与星形胶质细胞相接触,才对出现放疗抵抗
为了研究其中的分子机制,研究人员对对照组细胞和共培养的脑转移癌细胞进行RNA测序,结果发现S100A9是上调最显著的基因,动物模型和人脑转移癌标本中S100A9也高表达。
而S100A9的高表达是由星形胶质细胞分泌的CXCL1和TGG-α所诱导,向体外培养的细胞中添加以上的两种细胞因子,可诱导脑转移癌细胞高表达S100A9,并变得对放疗抵抗。
以上研究表明,S100A9可能参与脑转移癌细胞对放疗抵抗的机制中。
为了验证这一点,研究人员将重组S100A9加入到体外对放射敏感的脑转移癌细胞系中,结果发现肿瘤细胞对放疗的敏感性提高了3倍。而在将细胞S100A9沉默后再与脑组织薄片培养后,肿瘤细胞仍然对放疗敏感。这就坐实了S100A9即是导致肿瘤放疗抵抗的“元凶”。
那S100A9是如何导致原本对放疗敏感的脑转移癌细胞变得对放疗耐药呢?
通过转录组学分析,研究人员发现在对放疗抵抗的脑转移癌中,S100A9的受体RAGE在受到放射刺激后高表达,且在动物模型及和人脑转移癌标本中同样如此,通路富集分析显示RAGE下游的NF-κB信号通路被明显激活。
这些数据数据表明,脑转移癌细胞可表达和分泌S100A9,并与受放射诱导高表达的RAGE受体结合,激活NF-κB介导放疗抵抗。
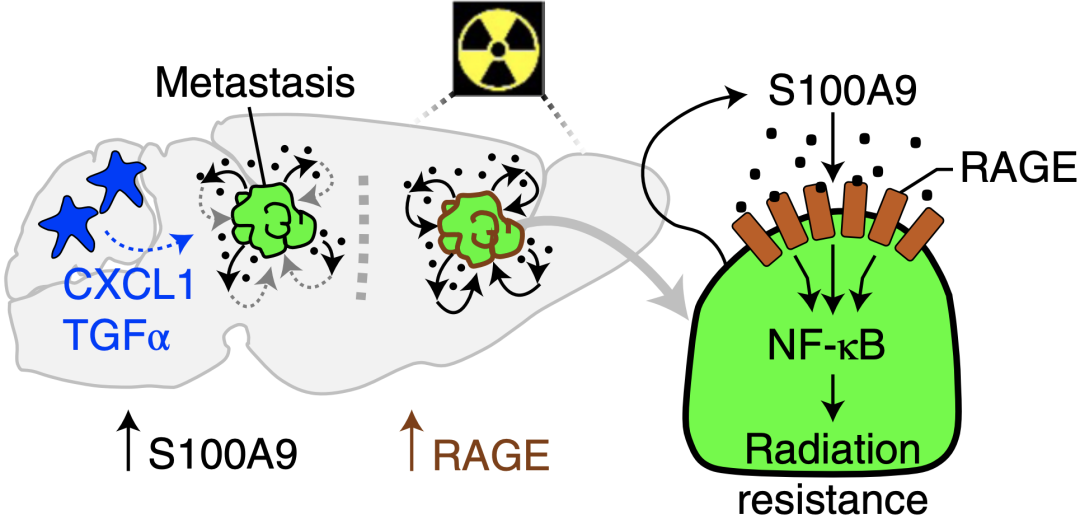
脑转移癌细胞通过S100A9介导放疗抵抗机制
紧接着,研究人员在体内研究了S100A9对放疗敏感性的作用,构建了H2030-BrM细胞S100A9被沉默的肺癌脑转移模型。
结果显示,肿瘤对放疗的抵抗消失了,与对照组(H2030-BrM细胞野生型肺癌脑转移模型)相比,放疗显著延长了小鼠的生存期。在乳腺癌脑转移动物模型中也有类似的现象。
然后研究人员在体内证实了S100A9的确是通过激活NF-κB/JunB信号通路,来介导肿瘤的放疗抵抗。
由于S100A9不仅可由肿瘤细胞所表达,中性粒细胞和单核细胞中也可分泌S100A9。为了验证放疗抵抗是否是由肿瘤特异性分泌的S100A9所介导,研究人员构建了S100A9基因敲除小鼠模型,然后将野生型E0771-BRM细胞植入脑内构建脑转移模型,结果显示肿瘤对放疗依旧抵抗。由此证实了放疗抵抗的确是由脑转移癌细胞分泌的S100A所介导。
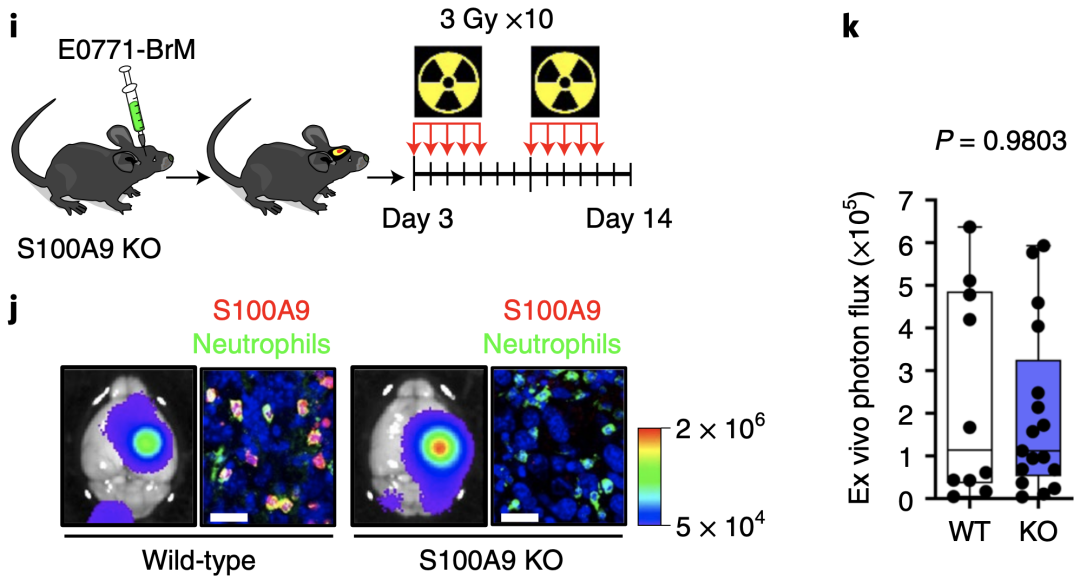
S100A9基因敲除小鼠脑转移模型对放疗抵抗
鉴于S100A9与脑转移癌放射敏感性的相关性,研究人员在临床人群中研究了S100A9与脑转移癌患者(接受标准治疗,其中包括放疗)预后的关系。
通过对肺癌(n=22)、乳腺癌(n=42)、和黑色素瘤(n=34)脑转移癌患者的临床标本与随访数据进行分析,研究人员发现,肺脑转移癌标本中S100A9表达水平与全脑放疗后肿瘤复发时间相关,乳腺癌和黑色素瘤脑转移癌标本中S100A9表达水平与生存率显著相关。这强烈提示了S100A9作为预测放疗敏感性标志物的价值。
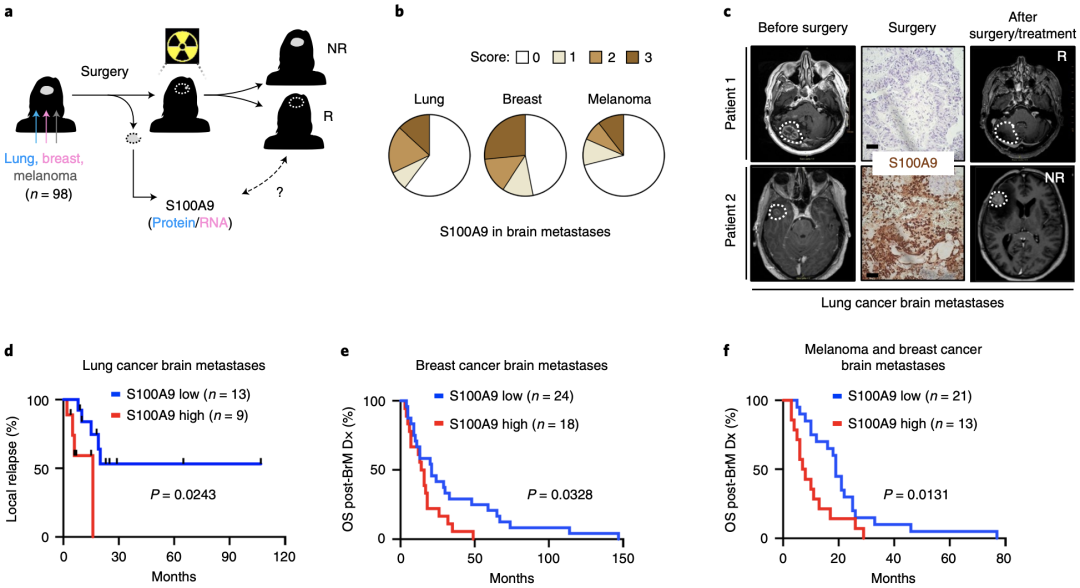
脑肿瘤标本S100A9水平可作为预测放疗敏感性标志物
考虑到有些脑转移癌患者已丧失手术机会,无法取到颅内肿瘤标本来评价S100A9的表达水平,研究人员还研究了血液中S100A9水平与患者放疗敏感性的关系。
他们通过分析71名脑转移癌患者的血液样本和临床数据发现,血液中的S100A9水平同样可以用来预测接受标准治疗(包括放疗)患者的预后,不过这还需要进行更大规模的临床研究来验证。
为了让那些S100A9水平高的患者同样享受到放射治疗的益处,研究人员不禁想到,这种放疗抵抗能否被逆转呢?
非常幸运的是,现有的RAGE抑制剂FPS-ZM1对血脑屏障的穿透性非常好[5]。研究人员通过对肺癌脑转移小鼠和乳腺癌脑转移小鼠使用FPS-ZM1后,果然发现原本应对放疗抵抗的肿瘤变得对治疗敏感了。
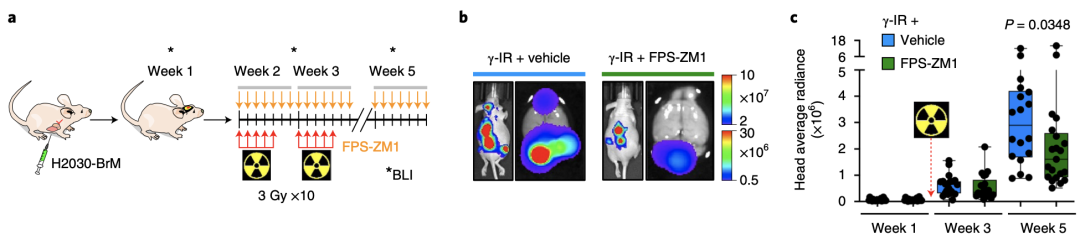
RAGE抑制剂FPS-ZM1可逆转肿瘤的放疗抵抗
总的来说,Valiente团队发现了S100A9介导了脑转移癌的放疗抵抗,且可作为潜在的生物标志物预测患者对放疗的敏感性,从而达到个性化治疗的目的。据了解,研究人员已启动一项前瞻性多中心研究,以评估S100A9对放疗敏感性的预测价值。
更为重要的是,这种放疗抵抗可被RAGE抑制剂所逆转,且RAGE抑制剂用于治疗阿尔茨海默病已进入临床试验阶段[6]。在不久的未来,该药物或真的可以作为放疗增敏剂进入临床使用,改善脑转移癌患者预后。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


