Nature子刊:杜文静/江鹏合作报道苹果酸酶代谢调控突变体p53蛋白的稳定性
来源:中国生物技术网 2022-03-04 12:54
中国医学科学院基础医学研究所(北京协和医学院基础学院)杜文静课题组与清华大学江鹏课题组合作在Nature Metabolism杂志发表了题为“Malic enzyme 2 maintains protein stability of mutant p53 through 2-hydroxyglutarate”的研究论文。该研究工作揭示
中国医学科学院基础医学研究所(北京协和医学院基础学院)杜文静课题组与清华大学江鹏课题组合作在Nature Metabolism杂志发表了题为“Malic enzyme 2 maintains protein stability of mutant p53 through 2-hydroxyglutarate”的研究论文。
该研究工作揭示了ME2及其产物2-HG在促进肿瘤生长中的重要作用。
在哺乳动物细胞中,有三种苹果酸酶的异构体:一种细胞膜NADP+依赖性的异构体(ME1),一种线粒体NAD(P)+依赖性的异构体(ME2)和一种线粒体NADP+依赖性的异构体(ME3),其中ME1和ME2是主要的异构体。在美国宾夕法尼亚大学杨小鲁教授实验室进行博后训练期间,杜文静和江鹏合作发表于Nature的一项研究发现苹果酸酶和p53之间的相互调控在细胞衰老和代谢中的重要作用,并且首次证明了苹果酸酶也是细胞内NADPH的主要来源(Jiang, Du et al. 2013)。
为了系统揭示苹果酸酶的生理病理功能,杜文静教授课题组近年来一直聚焦于不同环境和条件下苹果酸酶及其相关代谢产物的功能和调控机制研究。该组研究人员在2021年发表于Nature Metabolism的一项研究发现在脂肪细胞和肿瘤细胞内,苹果酸酶代谢产生的NADPH与HDAC3直接结合并抑制HDAC3的活性,从而调控了细胞的表观遗传状态,揭示了HDAC3作为细胞内NADPH的感受器可以感知NADPH的水平变化(Li, Kou et al. 2021)。
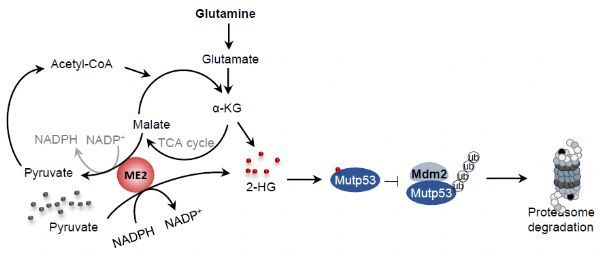
在本项目研究工作中,研究人员发现在肿瘤细胞内,苹果酸酶2 (ME2)可以通过调控2-羟基戊二酸(2-HG)的合成而增加突变体p53的蛋白稳定性。过表达ME2可以增加细胞内2-羟基戊二酸(2-HG)的产生,反之,敲低ME2则减少了细胞内2-HG的水平。深入的机制探索发现,2-HG可以直接与突变体p53结合,通过减少Mdm2介导的mutp53的泛素化和降解,从而增强mutp53的蛋白稳定性;但对于野生型p53没有此功能。有意思的是, ME2除了通过调整细胞谷氨酰胺代谢来调控2-HG的水平,也具有催化pyruvate和NADPH来直接合成2-HG的能力。最后,研究人员利用小鼠成瘤实验证明,2-HG的补充显着增加ME2缺失细胞的肿瘤生长,但不能增加去除了mutp53的肿瘤生长。
综上所述,本研究发现ME2可能具有利用pyruvate和NADPH产生2-HG的催化功能,以及mutp53可作为细胞内2-HG的感受器而感知2-HG的水平变化。该研究部分解释了在肿瘤中突变体p53高表达,并且比野生型p53蛋白更加稳定的原因。结合研究人员他们前期发现的ME2负反馈调控野生型p53的研究(Jiang, Du et al. 2013),该研究表明ME2不仅可以反馈抑制野生型p53,也可以稳定突变体p53,表明ME2可能是肿瘤治疗的一个有价值的靶标。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。