《自然》子刊:无中生有,化钝为敏!MD安德森癌症中心找到能增强实体瘤免疫治疗效果的新方法
来源:奇点糕 2022-12-19 11:51
肿瘤细胞能够通过表达免疫检查点的配体等机制,逃避免疫系统的识别和攻击。除了PD-1/PD-L1外,肿瘤细胞还高表达CD47,通过与巨噬细胞表面的SIRPα结合
肿瘤细胞能够通过表达免疫检查点的配体等机制,逃避免疫系统的识别和攻击。除了PD-1/PD-L1外,肿瘤细胞还高表达CD47,通过与巨噬细胞表面的SIRPα结合,释放抑制巨噬细胞吞噬的“别吃我”信号,从而逃避被巨噬细胞吞噬[1]。
以抗PD-1/PD-L1和抗CD47为代表的免疫检查点抑制疗法,在多种肿瘤中显示出令人鼓舞的效果。然而,相比于血液肿瘤,实体肿瘤对免疫治疗的反应差强人意,原因之一是实体肿瘤细胞相对缺乏能促进免疫功能的膜蛋白[2]。
SLAMF7是一种只表达于血液和免疫系统的自身受体配体,血液肿瘤细胞表面的SLAMF7结合巨噬细胞等免疫细胞表面的SLAMF7,释放“吃我”信号,促进巨噬细胞对肿瘤的吞噬和抗原呈递[3]。由于实体肿瘤细胞不表达SLAMF7,巨噬细胞等抗原呈递细胞对它们的吞噬和处理能力不够强大,制约了后续T细胞对实体肿瘤的杀伤。
因此,对实体肿瘤细胞进行人工修饰,使其“无中生有地表达”SLAMF7,以增强实体细胞的肿瘤免疫原性,促进实体肿瘤对免疫细胞敏感,成为了一种富有潜力的免疫转化策略。
为此,德州大学MD安德森癌症中心的Wen Jiang联合Betty Y. S. Kim,基于纳米佐剂技术,开发了一种实体肿瘤通用的纳米生物偶联物平台——双特异性肿瘤转化纳米颗粒(BiTNs)。它在实体肿瘤细胞的表面添加SLAMF7,从而促进巨噬细胞吞噬实体肿瘤细胞,并激活吞噬细胞的cGAS–STING通路,使实体肿瘤对免疫检查点抑制治疗敏感。相关结果近日发表于国际顶级期刊Nature Nanotechnology上[4]。
 论文首页截图
论文首页截图
BiTNs设计精巧,在纳米颗粒载体上同时偶联SLAMF7蛋白和靶向实体肿瘤细胞的抗体,通过抗体牢固地结合实体肿瘤细胞,进而间接地把SLAMF7蛋白固定在细胞表面,激活巨噬细胞对肿瘤细胞的吞噬作用。
研究人员首先在HER2阳性的乳腺癌细胞上对BiTNs的免疫转化能力进行了检测。此时,BiTNs因偶联的抗体是HER2抗体,称为BiTNHER。
巨噬细胞在体外和乳腺癌细胞共培养,添加BiTNHER后,吞噬HER2阳性乳腺癌细胞的能力提高,对HER2阴性乳腺癌细胞的吞噬作用无变化,显示BiTNHER的高靶向性。而在添加SLAMF7抗体或者敲低巨噬细胞的SLAMF7后,巨噬细胞对HER2阳性乳腺癌细胞的吞噬减弱,提示BiTNHER把乳腺癌细胞从HER2阳性转化为SLAMF7阳性,启动巨噬细胞的吞噬。
由于抗体能通过自身的Fc片段结合巨噬细胞的Fc受体,诱导抗体依赖性细胞吞噬作用[5]。为排除HER2抗体Fc片段在BiTNHER促进巨噬细胞吞噬效应中的作用,研究人员敲除了HER2抗体Fc片段,发现巨噬细胞的吞噬能力虽然略有降低,但仍对HER2阳性乳腺癌细胞显示出强大和特异的吞噬作用,证明BiTNs的促吞噬作用主要是通过SLAMF7-SLAMF7通路来介导的。
BiTNHER本身即可诱导巨噬细胞中等强度的吞噬作用,但和CD47抗体联用时,不仅能使巨噬细胞对HER2阳性乳腺癌细胞的吞噬能力更上一层楼,而且还诱导了更高水平的抗原呈递,T细胞活化和增殖。
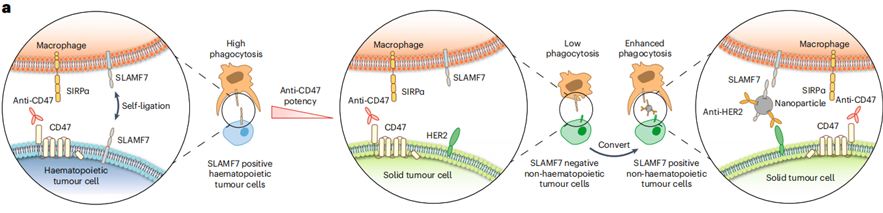 BiTNHER的结构和工作原理示意图
BiTNHER的结构和工作原理示意图
体外实验证明了BiTNHER和抗CD47联合治疗启动肿瘤免疫应答的强大能力。接下来,研究人员利用动物模型,在体内检验BiTNHER的抗肿瘤潜力。
与HER2阴性乳腺癌小鼠以及BiTNHER或抗CD47单一疗法相比,BiTNHER和抗CD47联合治疗HER2阳性乳腺癌小鼠,能明显抑制肿瘤生长,显著降低肿瘤负担并延长生存期。
在联合治疗后,研究人员对瘤内浸润的免疫细胞进行分析,发现巨噬细胞活性增强,NK细胞和DC细胞数量增加,T细胞,尤其是CD8+效应T细胞增多,抑制免疫的Treg细胞减少。这些结果表明BiTNs通过促进巨噬细胞吞噬,连接先天免疫和适应性免疫,增强免疫疗法对肿瘤细胞的清除。
此外,研究人员还发现,联合治疗小鼠的外周血IL-2和IFN-γ水平增加,脾脏中幼稚T细胞减少,脾细胞向记忆T细胞表型转化,提示BiTNs能激活全身免疫。治疗前后小鼠血细胞计数无显著差异,只有淋巴细胞略有增加,支持BiTNs治疗的安全性。
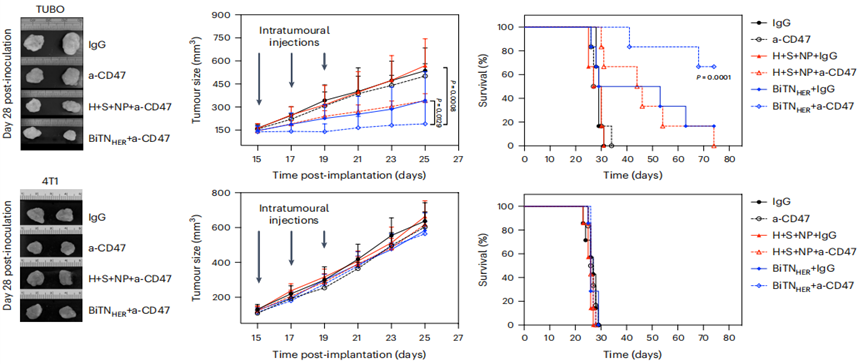
BiTNHER和抗CD47联合治疗HER2阳性乳腺癌小鼠(TUBO)效果显著
抑制CD47从而激活肿瘤免疫的机制是cGAS–STING途径[6]。cGAS–STING是细胞质内重要的免疫应答通路,在巨噬细胞吞噬肿瘤细胞后,巨噬细胞内的cGAS识别肿瘤细胞DNA片段并发生变化,进而激活STING,然后使转录因子IRF3磷酸化,磷酸化的IRF3进入细胞核,诱导I型IFN和其他免疫调节因子的转录。
那么,BiTNHER在促进巨噬细胞吞噬肿瘤细胞后,对肿瘤细胞清除的增强机制是否同样依靠cGAS–STING途径?
研究人员对此进行了验证,敲除HER2阳性乳腺癌小鼠的STING,则BiTNHER治疗不再影响肿瘤的生长和小鼠的生存。BiTNHER处理后,和STING正常的荷瘤鼠相比,STING敲除的荷瘤鼠肿瘤内巨噬细胞IRF3磷酸化和核移位减少,IFN-α和IFN-β转录水平下调。这些结果证实,BiTNs的抗肿瘤作用是通过激活巨噬细胞的cGAS–STING途径介导。
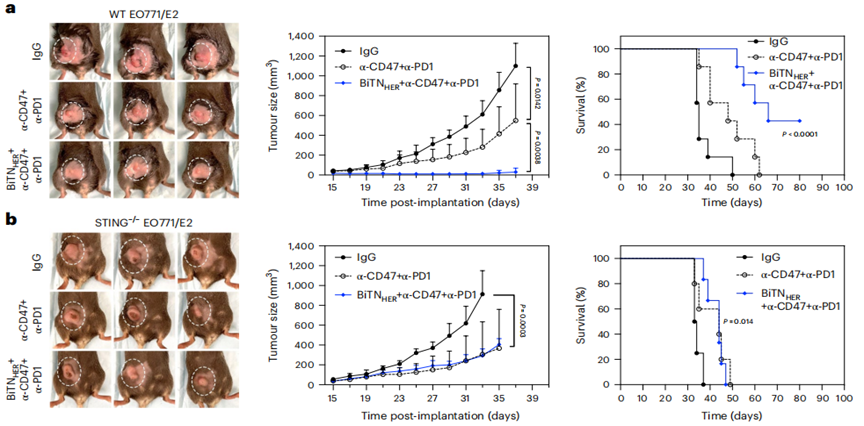
STING敲除的HER2阳性乳腺癌小鼠对BiTNHER的治疗反应无效
最后,为了证明BiTNs平台的多功能性,通用于表达不同受体的多种实体肿瘤,研究人员在三阴性乳腺癌上进行了演示。
三阴性乳腺癌细胞表面高表达叶酸受体FR,为了靶向三阴性乳腺癌,BiTNs把纳米载体偶联的HER2抗体更换为叶酸,新构建的BiTNs称为BiTNFo。BiTNFo使三阴性乳腺癌细胞从FR阳性转化为SLAMF7阳性表型。
由于三阴性乳腺癌小鼠还高表达PD-1/PD-L1,为增强免疫疗效,BiTNFo联合抗CD47和抗PD-1进行三联治疗。相比于仅有抗CD47和抗PD-1的二联疗法,三联治疗能显著抑制肿瘤生长和转移,降低术后复发,延长生存,激活免疫应答,增加瘤内IFN-γ+CD8+T细胞和DC细胞的浸润,降低Treg等免疫抑制细胞的数量。这些结果表明,BiTNs是免疫检查点抑制疗法的一种强效佐剂。
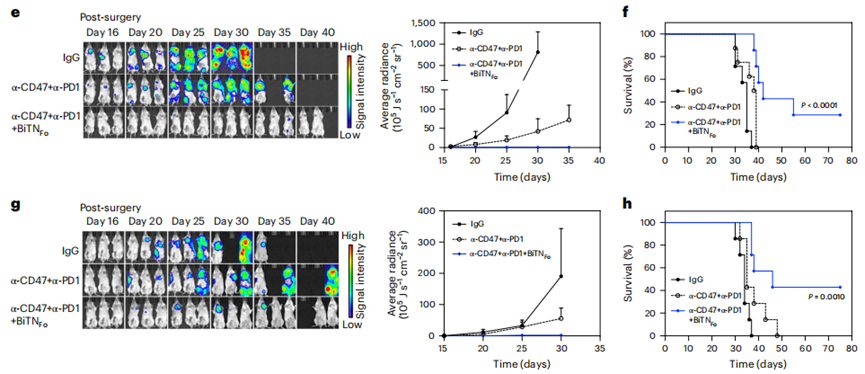
BiTNFo与抗CD47和抗PD-1的组合强烈增强免疫疗效
总体而言,研究人员借鉴血液肿瘤细胞的促免疫机制,利用纳米技术,为实体肿瘤研发了一种能增强免疫的通用佐剂BiTNs。BiTNs集SLAMF7蛋白和肿瘤细胞配体于一身,通过配体结合肿瘤细胞的特异性受体,把SLAMF7移花接木给实体肿瘤细胞;通过更换不同的配体,适用于各种实体肿瘤。
BiTNs将实体肿瘤细胞从低免疫原性转化为SLAMF7高表型,高效地促进了巨噬细胞吞噬肿瘤细胞和呈递肿瘤抗原,大大增强了CD47抑制剂和PD1抑制剂的疗效。这种免疫转化方法有望推动实体肿瘤的免疫治疗再上新台阶。
参考文献:
[1] Jiang Z, Sun H, Yu J, Tian W, Song Y. Targeting CD47 for cancer immunotherapy. J Hematol Oncol. 2021;14(1):180. Published 2021 Oct 30.doi:10.1186/s13045-021-01197-w
[2] Jalil AR, Andrechak JC, Discher DE. Macrophage checkpoint blockade: results from initial clinical trials, binding analyses, and CD47-SIRPα structure-function. Antib Ther. 2020;3(2):80-94. doi:10.1093/abt/tbaa006
[3] Chen J, Zhong MC, Guo H, et al. SLAMF7 is critical for phagocytosis of haematopoietic tumour cells via Mac-1 integrin. Nature. 2017;544(7651):493-497. doi:10.1038/nature22076
[4] Lu Y, Huntoon K, Lee D, et al. Immunological conversion of solid tumours using a bispecific nanobioconjugate for cancer immunotherapy [published online ahead of print, 2022 Nov 10]. Nat Nanotechnol. 2022;10.1038/s41565-022-01245-7. doi:10.1038/s41565-022-01245-7
[5] Kamen L, Myneni S, Langsdorf C, et al. A novel method for determining antibody-dependent cellular phagocytosis. J Immunol Methods. 2019;468:55-60. doi:10.1016/j.jim.2019.03.001
[6] von Roemeling CA, Wang Y, Qie Y, et al. Therapeutic modulation of phagocytosis in glioblastoma can activate both innate and adaptive antitumour immunity. Nat Commun. 2020;11(1):1508. Published 2020 Mar 20. doi:10.1038/s41467-020-15129-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


