干细胞“变”输尿管!Nat Commun成功用多能干细胞体外构建具蠕动功能的输尿管类器官
来源:生物谷原创 2025-06-25 09:12
本研究成功从鼠和人多能干细胞体外诱导输尿管基质祖细胞,与上皮细胞重构具蠕动功能的输尿管结构,还能构建全PSC来源的输尿管类器官,可用于研究输尿管发育与疾病。
在人体泌尿系统的精密运作中,输尿管如同一条高效的“输水管道”,肩负着将肾脏生成的尿液输送至膀胱的重要使命。然而,长期以来,尽管多能干细胞(PSCs)在肾脏类器官构建领域取得了显著进展,但始终无法有效生成输尿管结构,这一难题不仅限制了我们对输尿管发育机制的深入理解,也成为阻碍功能性肾脏类器官应用于移植治疗的关键瓶颈。
近日,Nat Commun刊登的一项重磅研究In vitro generation of a ureteral organoid from pluripotent stem cells,首次实现了从鼠和人多能干细胞体外诱导输尿管基质祖细胞(SPs),并成功构建具有生理功能的输尿管类器官,为泌尿系统疾病研究与再生医学发展带来了革命性突破。

研究核心:模拟体内发育路径,解锁输尿管诱导密码
研究团队以小鼠胚胎后中间中胚层(posterior intermediate mesoderm)的输尿管基质祖细胞发育过程为模板,设计了一套精妙的体外诱导方案。通过单细胞RNA测序(scRNA-seq)技术,研究者深入解析了胚胎不同发育阶段(E11.5、E13.5、E15.5)肾脏基质细胞的分子特征,成功鉴定出腹侧SPs(ventral SPs)的特异性标记基因,如Tbx18、Gata2、Foxf1及Itga8等。谱系追踪实验进一步证实,腹侧SPs起源于E9.5胚胎的Osr1+后中间中胚层,为体外诱导提供了精准的细胞谱系依据。
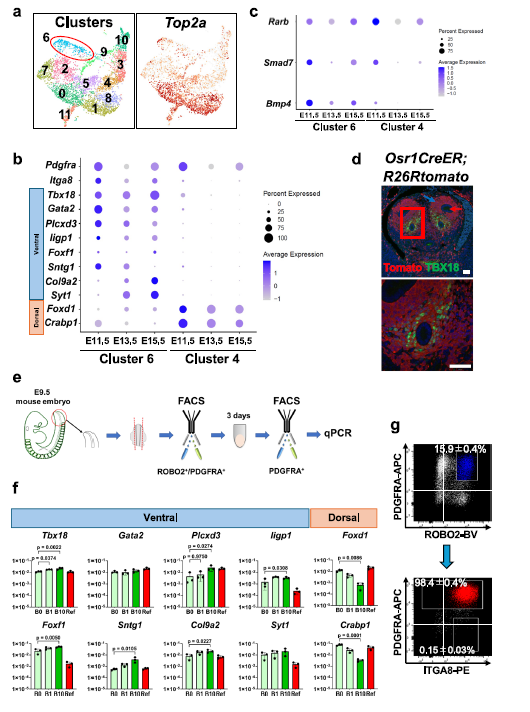
图 1:从E9.5小鼠胚胎诱导腹侧基质祖细胞(SPs)
在此基础上,研究团队通过优化诱导条件发现,在视黄酸(RA)和FGF9的基础上添加BMP4,能够高效促进后中间中胚层细胞向腹侧SPs分化。这一诱导方案在鼠胚胎干细胞(ESCs)和人诱导多能干细胞(iPSCs)中均展现出良好的普适性:鼠ESCs来源的腹侧SPs经诱导后,90.5%的细胞表达Tbx18,且特异性标记基因如Iigp1、Sntg1、Syt1的表达率均超过70%;人iPSCs来源的腹侧SPs同样表现出典型的分子特征,TBX18、GATA2、FOXF1等基因的表达水平显著高于背侧SPs,且ITGA8阳性细胞比例显著提升。
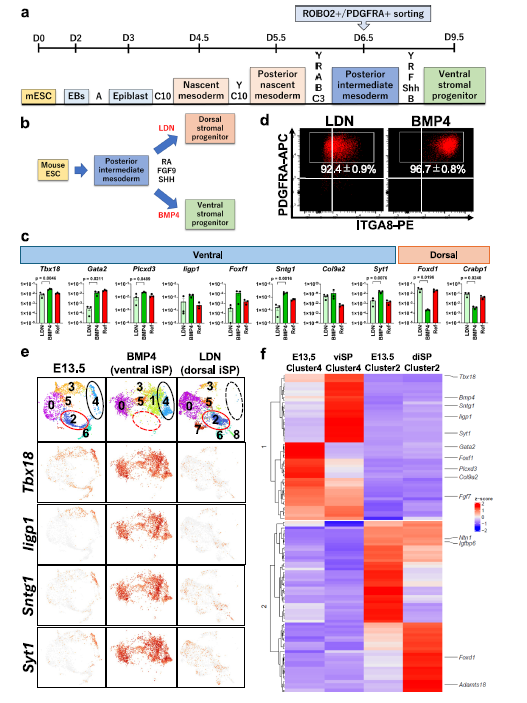
图 2:从小鼠胚胎干细胞(ESCs)诱导腹侧SPs
功能验证:类器官重构输尿管生理功能,疾病建模初显成效
为验证腹侧SPs的功能活性,研究团队将鼠ESCs诱导的腹侧SPs与胚胎输尿管上皮细胞共培养,成功重构出具有多层结构的输尿管组织。这些重构输尿管不仅呈现出典型的三层上皮(表层细胞、中间细胞、基底细胞)和三层间充质(固有层、平滑肌层、外膜)结构,更重要的是展现出节律性蠕动收缩——其收缩强度与胚胎来源的输尿管相当,且经单细胞测序证实,重构输尿管的基因表达谱与出生后7天(P7)的天然输尿管高度相似,提示其已具备相当程度的成熟度。
在疾病建模领域,该技术展现出巨大应用潜力。研究人员利用CRISPR-Cas9技术构建TBX18突变的人iPSC系,发现突变细胞诱导的腹侧SPs中,GATA2、FOXF1等腹侧标记基因表达显著下调,而背侧肾间充质基因(FOXD1、WT1、WNT4)表达上调。当这些突变SPs与胚胎输尿管上皮细胞共培养时,重构输尿管完全丧失伸长能力,平滑肌分化障碍,多层结构发育失败,完美复现了临床TBX18突变导致的输尿管肾盂连接处梗阻及肾积水表型,为深入研究人类输尿管发育异常疾病提供了理想的体外模型。
全PSC来源类器官
研究的另一重大突破在于实现了完全由多能干细胞构建输尿管类器官。团队将诱导的腹侧SPs与PSC来源的输尿管芽(UBs)结合,成功生成了鼠和人来源的输尿管样球形类器官。尽管这些类器官尚未形成天然输尿管的管状结构,但其内部可观察到上皮和间充质的分层分化,且鼠来源类器官展现出明显的收缩活动。值得注意的是,人iPSC来源的类器官虽未检测到收缩,但其间充质中ACTA2和POSTN阳性细胞均匀分布,上皮细胞表达UPK1B和ΔNP63,提示跨物种的间充质-上皮相互作用已部分建立,为后续优化提供了关键线索。
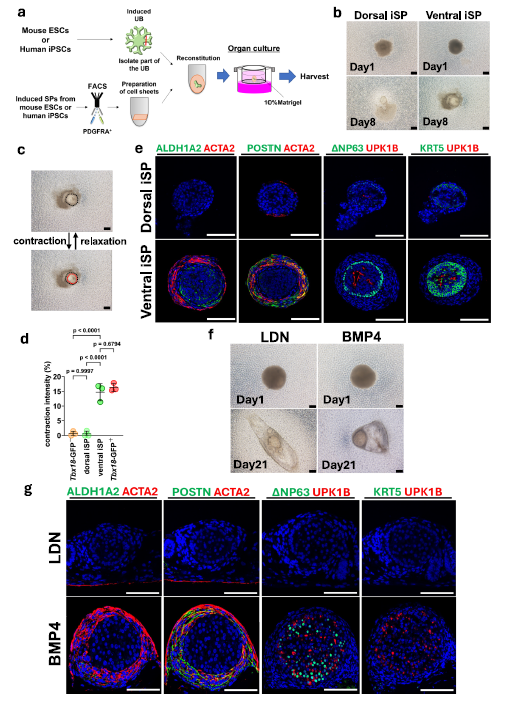
图 3:完全由鼠和人PSCs衍生的输尿管样类器官的生成
小结
这项研究首次系统性揭示了输尿管基质祖细胞的发育程序,建立了从多能干细胞到功能性输尿管类器官的完整诱导体系。从基础研究角度,该技术为解析输尿管发育过程中间充质-上皮相互作用的分子机制提供了强大工具;在转化医学领域,其不仅为输尿管发育异常相关疾病(如肾积水、输尿管梗阻)的病理研究和药物筛选奠定了基础,更朝着构建具备尿液引流功能的“完整肾脏类器官”迈出了关键一步。
想象一下,未来或许能通过患者自体细胞诱导生成个性化输尿管类器官,不仅可用于精准模拟疾病病理过程,更可能与肾脏类器官结合,构建功能完备的体外泌尿单元,为终末期肾病患者带来器官移植的新希望。随着技术的不断优化,我们有理由相信,这项突破将推动泌尿系统再生医学从实验室走向临床,为万千患者重筑生命的“输水通道”。(生物谷Bioon.com)
参考文献:
Ibi Y, Miike K, Ohmori T, Cai CL, Tanigawa S, Nishinakamura R. In vitro generation of a ureteral organoid from pluripotent stem cells. Nat Commun. 2025;16(1):5309. Published 2025 Jun 20. doi:10.1038/s41467-025-60693-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


