Nature Genetics | 癌症基因组学的新突破:探索复杂基因型与表型关联的组合遗传策略
来源:生物探索 2024-03-06 11:28
该研究中研究人员通过将编码癌症相关基因事件的条形码慢病毒文库高效地随机引入到原代上皮细胞中,并将这些细胞移植到小鼠中以选择肿瘤原克隆。
Nature Genetics的报道“A combinatorial genetic strategy for exploring complex genotype–phenotype associations in cancer”提出了一种组合遗传策略,旨在通过在器官培养中应用多种遗传操作,快速生成具有临床相关性的膀胱和前列腺癌模型。这种策略的创新之处在于,它允许我们在单一模型中同时观察多个基因的相互作用和影响,从而深入揭示癌症发展过程中的复杂基因型与表型关联。此外,采用单细胞和空间解析的NGS技术,可以对肿瘤的克隆结构进行精确解析,进一步挖掘多基因驱动癌症表型的机制。

基因型与表型关联的复杂性
癌症作为一种遗传性疾病,其发展过程中基因型与表型之间的关联性极为复杂。这种复杂性不仅源于癌症本身的遗传多样性,还因为癌症的发展受到多种遗传和环境因素的共同影响。
基因变异与癌症发展
癌症的基因型通常指的是癌细胞中的基因组变异,包括基因突变、染色体重排、基因拷贝数变异等。这些变异能够直接或间接影响细胞的生长、分化和死亡,从而推动癌症的发展。例如,某些基因突变可能激活致癌基因或失活抑癌基因,导致细胞增殖失控。
表型多样性的遗传基础
癌症的表型不仅指肿瘤的形态特征,还包括其生物学行为,如侵袭性、转移能力和对治疗的反应。癌症表型的多样性在很大程度上是由其遗传多样性所驱动的。不同的基因变异组合可能导致不同的癌症表型,使得即使是同一类型的癌症也可能表现出不同的临床特征和治疗反应。
环境因素与基因互作
癌症的发展不仅受遗传因素的影响,还受到环境因素的共同作用。例如,吸烟、饮食习惯和环境污染等都可能与遗传因素相互作用,影响癌症的发展。这种基因-环境互作对于理解癌症的复杂性至关重要。
癌症遗传研究的挑战
由于癌症的遗传复杂性,理解基因型与表型之间的关系成为癌症研究中的一大挑战。这要求我们不仅要关注单个基因变异,还要考虑多基因之间的相互作用以及基因与环境因素之间的互作。因此,癌症遗传研究需要采用多学科、多方法的综合研究策略。
癌症模型的局限性及其影响
癌症模型作为理解和研究癌症机制的重要工具,其精确度和适用性直接影响着癌症治疗策略的制定和优化。然而,现有的癌症模型在模拟人类癌症的复杂性和多样性方面存在一定的局限性。
模型的代表性问题
当前常用的癌症模型包括体外细胞培养模型、动物模型等。这些模型虽然在一定程度上模拟了癌症的发展过程,但往往无法全面反映人类癌症的遗传异质性和复杂的肿瘤微环境。例如,体外培养的癌细胞由于缺乏体内微环境的交互作用,其行为可能与体内实际情况有所不同。
动物模型的限制
动物模型,尤其是小鼠模型,是癌症研究中的主要工具。然而,由于物种间的生理差异,小鼠模型无法完全复制人类的癌症特点。此外,基因工程鼠模型的建立时间长、成本高,这限制了其在高通量研究中的应用。
由于模型的局限性,通过这些模型筛选出的潜在药物或治疗策略可能在临床试验中表现不佳。这不仅延缓了新疗法的开发进程,也增加了研发成本。不准确的癌症模型可能导致对癌症发生和发展机制的理解存在偏差。例如,某些模型可能过度强调特定的信号通路或分子机制,而忽视了其他重要因素。面对现有癌症模型的局限性,研究人员需要寻找新的方法来更准确地模拟人类癌症。这包括开发更具代表性的细胞模型、利用先进的基因编辑技术改进动物模型,以及结合计算模型等多学科方法来增强研究的准确性和全面性。
组合遗传策略发展
组合遗传策略作为一种新兴的研究方法,正在逐渐显现其独特价值。该策略通过综合运用多种遗传学手段,深入探究癌症的遗传机制,为癌症治疗提供新的思路。组合遗传策略是指在单一实验模型中同时操作多个遗传变量,以模拟癌症的多基因性质。这种策略不仅关注单一基因的作用,更重视不同基因间的交互作用及其对癌症发展的综合影响。
组合遗传策略的实施方法
实施组合遗传策略通常包括基因编辑、多基因表达调控、以及基因组学分析等技术。近年来,CRISPR-Cas9等基因编辑技术的发展极大地促进了这一策略的实施。通过精确修改基因组,研究人员可以在细胞或动物模型中模拟多基因变异的复杂情形。
该研究中研究人员通过将编码癌症相关基因事件的条形码慢病毒文库高效地随机引入到原代上皮细胞中,并将这些细胞移植到小鼠中以选择肿瘤原克隆。这一系统能够生成基因型和表型多样性的肿瘤,并通过大规模并行单细胞慢病毒条形码测序来识别合作的致癌因子,进而推断特定癌症表型。
研究人员利用流式细胞分选技术从小鼠膀胱尿路上皮细胞和前列腺上皮细胞中分离出细胞,然后通过与浓缩慢病毒混合并植入基质凝胶中,来提高慢病毒的转导效率。通过这种方法,实现了几乎100%的转导效率,每个细胞可引入10至20个拷贝的慢病毒。
接下来,研究人员选取了与膀胱癌和前列腺癌相关的常见突变基因,并将这些基因作为开放阅读框(ORFs)或shRNAs克隆到带有条形码的慢病毒构建体中。这些慢病毒库被用于感染原代上皮细胞,然后这些细胞与小鼠的胚胎膀胱间质或泌尿生殖窦间质重组,并移植到小鼠体内。在小鼠体内,选择出具有肿瘤形成能力的细胞克隆。通过对这些肿瘤的单细胞DNA扩增测序,可以确定克隆结构并解析致癌基因事件。
这一组合基因策略为研究癌症的基因型与表型之间复杂关系提供了一种新的方法,尤其是在原代上皮细胞中快速研究这些关系的能力。通过这种方法,研究人员能够产生多种与人类膀胱癌和前列腺癌表型多样性相一致的小鼠模型,有助于更深入地理解癌症的发病机制,并可能对未来的癌症治疗策略产生。
组合遗传策略的应用领域
组合遗传策略被广泛应用于癌症的多个研究领域,包括肿瘤生物学、药物筛选、以及治疗方法的研发等。它能够帮助科学家更深入地理解肿瘤的发生机制,同时为开发新型抗癌药物提供理论基础。
关键方法
组合基因策略 (Combinatorial Genetic Strategy):研究团队使用这种策略来模拟癌症的复杂基因型-表型 (genotype-phenotype) 关系。这涉及到将多种与癌症相关的基因改变(例如激活突变或基因沉默)引入到细胞中。
使用带有条形码的慢病毒库 (Barcode Lentiviral Libraries):研究者构建了含有癌症相关基因事件的慢病毒库,并通过条形码来标记每种基因事件。这些慢病毒随机并高效地感染原代上皮细胞,使得每个细胞可能包含不同的基因组合。
原代上皮细胞 (Primary Epithelial Cells) 的使用:研究中用到了来自小鼠膀胱和前列腺的原代上皮细胞。这些细胞被慢病毒感染后,能够在体外组织类培养 (organoid cultures) 中生长。
体内模型建立:接着,感染后的细胞被植入小鼠体内,以促进肿瘤的形成。这个过程允许生物学上选择那些具有肿瘤生成能力的克隆。
单细胞或空间解析的下一代测序 (Single-cell or Spatially Resolved Next-Generation Sequencing):研究者使用这些技术来分析肿瘤的克隆结构 (clonal architecture)。这包括鉴定哪些基因改变共同出现在同一个克隆中,从而揭示可能驱动癌症特定表型的多基因 (polygenic) 机制。
临床相关性评估:通过对所生成的肿瘤模型进行详细的形态学和分子特征分析,研究人员能够评估这些模型在模拟人类癌症方面的相关性。
研究发现
多样化的癌症模型生成:研究成功利用组合基因策略(combinatorial genetic strategy)在小鼠中生成了不同类型的膀胱和前列腺癌模型。这些模型在形态学上表现出与人类癌症相似的多样性,包括不同的组织学亚型。
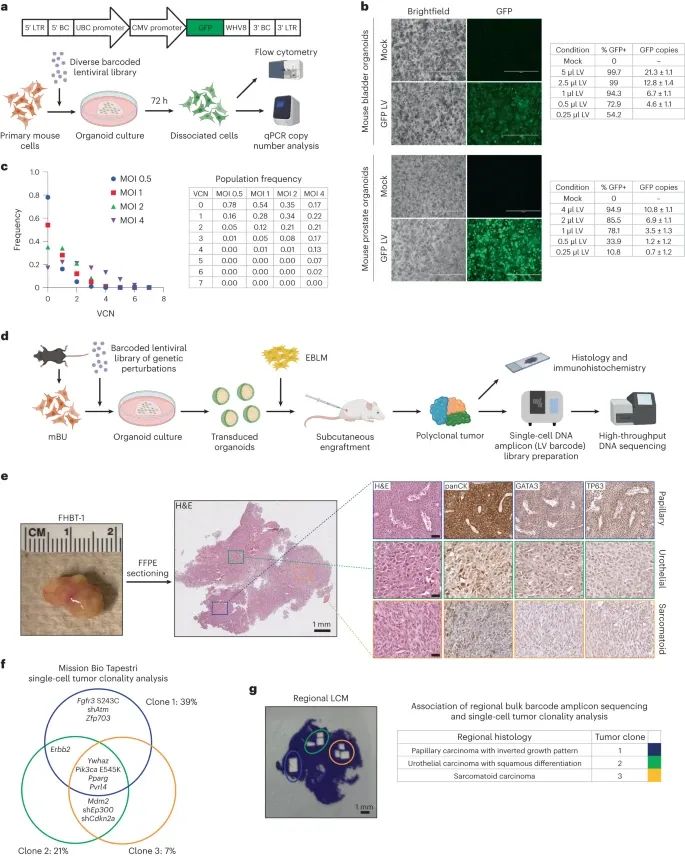
高效的慢病毒转导原代上皮细胞,将膀胱上皮细胞转化为具有多种癌症组织学特征的肿瘤(Credit: Nature Genetics)
肿瘤的克隆结构分析:通过单细胞测序(single-cell sequencing)和空间解析测序(spatially resolved sequencing)技术,研究揭示了肿瘤的复杂克隆结构(clonal architecture)。这种分析方法能够识别出哪些基因的改变共同出现在同一个肿瘤克隆中,从而揭示了可能驱动特定癌症表型的多基因(polygenic)机制。
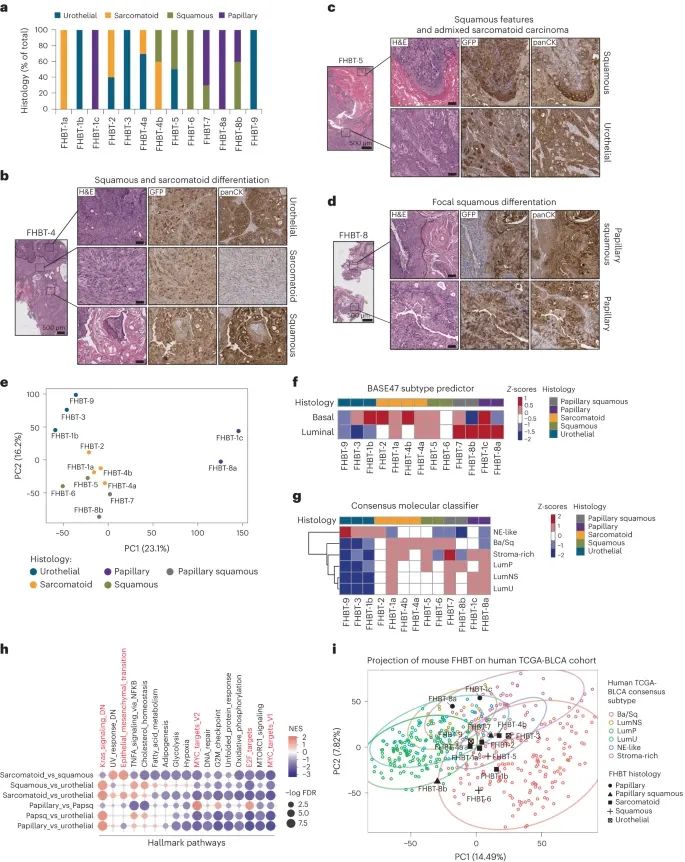
快速生成一系列临床相关且表型多样的膀胱癌模型(Credit: Nature Genetics)
基因型-表型关联:研究发现,特定的基因改变组合与特定的癌症表型关联。例如,在膀胱癌模型中,某些基因改变的组合与乳头状膀胱癌(papillary urothelial carcinoma)的形成密切相关。
临床相关性的证明:通过比较所生成的癌症模型与人类癌症的数据,研究证实了这些模型在模拟人类癌症的临床特征方面具有高度的相关性。这一发现对于未来癌症治疗方法的研究具有重要意义。
新的生物标记物和治疗靶点的发现:研究还可能揭示了新的生物标记物(biomarkers)和治疗靶点(therapeutic targets),这对于癌症的个体化治疗和新药的开发具有潜在价值。
研究亮点
创新的实验方法:研究团队开发了一种方法,通过将带有条形码的慢病毒库(barcode lentiviral libraries)随机高效地引入到原代上皮细胞中,再将这些细胞植入到小鼠体内进行肿瘤生成选择,这样可以生成具有基因型和表型多样性的肿瘤。
多样化的癌症模型:利用这种方法,研究人员能够快速生成多种临床相关的膀胱癌和前列腺癌模型。这些模型在形态学上与人类癌症高度相似,能够模拟癌症的多种组织学亚型。
深入的基因型-表型解析:通过单细胞或空间解析的下一代测序(next-generation sequencing)技术,研究人员能够详细解析肿瘤的克隆结构(clonal architecture),进而揭示多基因(polygenic)驱动癌症表型的机制。
临床相关性:该研究不仅增加了对癌症多样性的理解,而且提供了一种强大的工具,用于研究在不同基因背景下癌症的行为和治疗反应,这对癌症的精准治疗有重要意义。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


