Cell:同济大学袁健团队发现肿瘤细胞“帮凶”乳酸,并揭示其导致化疗耐药的新机制
来源:生物世界 2023-12-22 10:52
这项研究揭示了细胞代谢与同源重组修复之间的关键分子链接及生物学基础并且为靶向DNA修复克服肿瘤耐药提供了新的理论基础和潜在靶点。
同济大学医学院/附属东方医院袁健教授课题组(副教授陈玉平和博士后吴锦欢为论文第一作者)在 Cell 期刊发表了题为:Metabolic Regulation of Homologous Recombination Repair by MRE11 Lactylation 的研究论文。
该研究发现,在肿瘤细胞代谢中所产生的大量乳酸,成为肿瘤细胞的“帮凶”,帮助肿瘤细胞躲避化疗药物的杀伤,从而导致化疗耐药。该研究进一步揭示了蛋白乳酸化修饰链接肿瘤代谢与DNA损伤修复的关键分子机制,进而提供了潜在的肿瘤治疗靶点与策略。

研究团队首先从TCGA数据库发现了肿瘤代谢重编程与同源重组修复之间的关联,特别是乳酸脱氢酶A(LDHA)在此过程中的低表达与同源重组修复下调相关。他们进一步证实了乳酸化修饰参与了同源重组修复,并发现通过乳酸钠处理可以促进细胞泛乳酸化水平和同源重组修复,但并不增加细胞内乳酸水平。乳酸脱氢酶抑制剂能够显著抑制同源重组修复并增强化疗药物对肿瘤细胞的杀伤作用,初步证明了蛋白乳酸化修饰在同源重组修复中的作用。
在分子机制层面,研究团队筛选了几个关键的同源重组修复调控蛋白,发现MRE11(一种核酸酶,对起始DNA末端切割和同源重组修复具有重要的调控作用)具有最强的乳酸化修饰水平。进一步的实验结果表明,MRE11 K673位点的乳酸化修饰促进了MRE11与DNA结合,进而促进了DNA末端切割和同源重组修复。对MRE11 K673乳酸化的抑制或缺失突变都显著抑制了DNA修复过程。
高活性的同源重组修复通常导致肿瘤对化疗药物抵抗,研究团队进一步探索了MRE11 K673乳酸化修饰状态对铂类或PARP抑制剂化疗药物的影响。结果显示,高MRE11 K673乳酸化的肿瘤对化疗药物抵抗,而抑制MRE11 K673乳酸化能够增强化疗药物的疗效。为进一步特异性靶向抑制MRE11 K673乳酸化修饰杀伤肿瘤,他们设计和筛选了能够特异性抑制MRE11 K673乳酸化的小分子多肽,发现该多肽在体外细胞和者体内PDX模型能显著提高铂类或PARP抑制剂化疗对肿瘤的杀伤效果。这些结果表明了靶向抑制MRE11 K673乳酸化修饰是一个潜在提高化疗效果的策略。
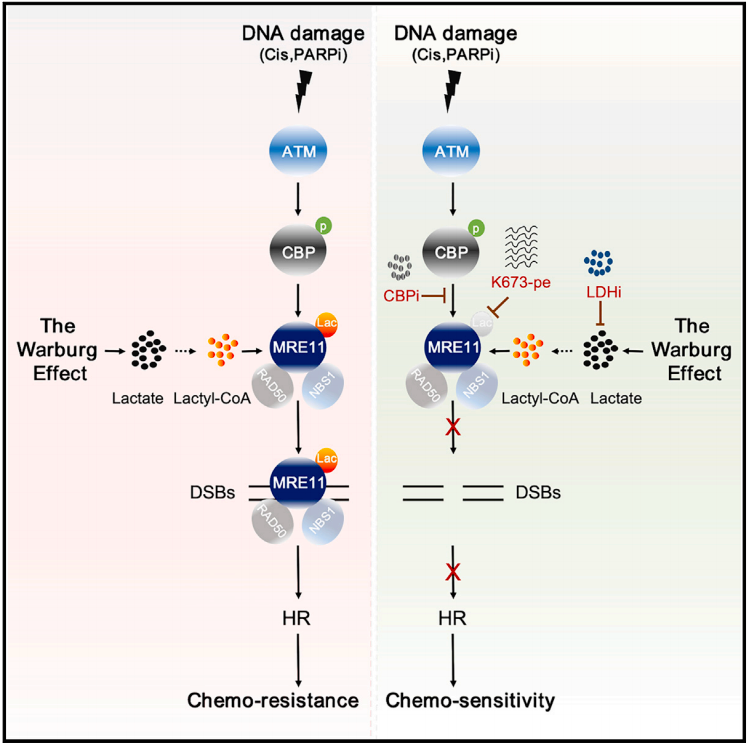
总的来说,这项研究揭示了细胞代谢与同源重组修复之间的关键分子链接及生物学基础并且为靶向DNA修复克服肿瘤耐药提供了新的理论基础和潜在靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


