JAMA ONCOLOGY | 实体瘤相关骨转移治疗新选择:MW032与Denosumab(地诺单抗)效用和安全性的对照分析
来源:生物探索 2024-02-15 15:46
MW032与denosumab在疗效、人群药代动力学和安全性方面具有生物相似性,这表明MW032可能成为治疗实体瘤相关骨转移患者的一个新的治疗选择。
发表于JAMA ONCOLOGY (IF 28.4)的研究“Efficacy, Safety, and Population Pharmacokinetics of MW032 Compared With Denosumab for Solid Tumor-Related Bone Metastases: A Randomized, Double-Blind, Phase 3 Equivalence Trial”,报道了一种名为MW032的药物,一种denosumab生物仿制药(biosimilar),用于治疗与实体瘤(solid tumor)相关的骨转移(bone metastases)。在这项随机、双盲、III期(phase 3)等效试验(equivalence trial)中,研究人员旨在评估MW032与denosumab在治疗实体瘤相关骨转移方面的效果是否等同。研究包括了701名患者,这些患者来自中国46个临床中心(clinical sites)。
研究结果表明,MW032与denosumab在疗效(efficacy)、人群药代动力学(population pharmacokinetics)和安全性(safety profile)方面具有生物相似性(biosimilarity),这表明MW032可能成为治疗实体瘤相关骨转移患者的一个新的治疗选择。

Highlights
生物相似性证明:研究成功证明了MW032与denosumab在治疗实体瘤(solid tumor)相关骨转移(bone metastases)方面具有等效的疗效(efficacy)。这一发现基于骨转换标志物(bone turnover markers)的评估和骨相关事件(skeletal-related events, SREs)的发生率,两组之间的差异在预先定义的等效边界(equivalence margins)内。
大规模、多中心的随机对照试验:这项研究为期53周,是在中国46个临床中心进行的大规模、多中心、随机、双盲的III期(phase 3)等效试验。研究共纳入了701名患者,这为MW032的疗效和安全性提供了强有力的证据。
安全性和人群药代动力学(population pharmacokinetics)评估:MW032不仅在疗效上与denosumab相似,而且在安全性和人群药代动力学方面也显示出相似性。这意味着MW032的安全性与denosumab相似,且MW032在不同患者群体中的药物动态行为与denosumab一致。
提高药物可及性:作为denosumab的生物仿制药(biosimilar),MW032的开发有潜力降低治疗成本,从而扩大患者对于这种有效治疗骨转移的药物的可及性和可负担性。
全面的疗效和安全性数据:研究提供了包括基线到第13周的尿液N-端肽/肌酐比率(urinary N-telopeptide/creatinine ratio, uNTx/uCr)的百分比变化等综合疗效指标,以及通过尿液和血液生物标志物的长期跟踪,对MW032与denosumab在治疗骨转移中的效果进行了全面评价。
为未来研究铺平道路:通过证明MW032的疗效和安全性,这项研究为进一步探索MW032在其他癌症类型和疾病状态中的应用提供了基础,有可能进一步扩大其治疗领域。
Strategies
研究设计(Study Design)
随机、双盲、III期(phase 3)等效试验:该研究为期53周,采用随机、双盲的设计,确保了研究的客观性和结果的可靠性。
多中心研究(Multicenter Study):在中国46个临床中心进行,增加了研究结果的普遍适用性。
参与者(Participants)
纳入标准(Inclusion Criteria):年龄≥18岁,有组织学证实的恶性肿瘤,放射学证据显示至少有一个骨转移,预期寿命超过6个月,东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)表现状态(performance status)≤2。
排除标准(Exclusion Criteria):明确的血液肿瘤病史或其他不适合本研究的医疗条件。
干预措施(Interventions)
治疗分配(Treatment Allocation):参与者1:1随机分配接受MW032或参考药物denosumab,通过皮下注射(subcutaneously)给药,每4周一次,直到第49周。
主要和次要终点(Main and Secondary Endpoints)
主要终点(Primary Endpoint):基线到第13周尿液N-端肽/肌酐比率(urinary N-telopeptide/creatinine ratio, uNTx/uCr)的自然对数转换后的百分比变化。
次要终点(Secondary Endpoints):包括uNTx/uCr和骨特异性碱性磷酸酶(bone-specific alkaline phosphatase, s-BALP)从基线到第5、25、37和53周的百分比变化,以及SREs的发生率。
安全性和药代动力学评估(Safety and Pharmacokinetics Assessments)
安全性监测(Safety Monitoring):根据国家癌症研究所(NCI)的普通术语标准(Common Terminology Criteria for Adverse Events, CTCAE)版本5.0评估不良事件的发生率和严重性。
药代动力学(Population Pharmacokinetics):通过分析血药浓度和其他药动学参数来评估MW032与denosumab的相似性。
Advancements
疗效(Efficacy)结果
主要终点(Main Endpoint):MW032组和denosumab组在基线到第13周的尿液N-端肽/肌酐比率(urinary N-telopeptide/creatinine ratio, uNTx/uCr)的百分比变化上显示出相似的结果。两个治疗组的平均变化率分别为-72.0%和-72.7%,这表明两种药物在抑制骨转换(bone turnover)方面具有相似的效力。
次要终点(Secondary Endpoints):uNTx/uCr和骨特异性碱性磷酸酶(bone-specific alkaline phosphatase, s-BALP)的变化也显示出两种治疗之间没有显著差异,进一步证明了MW032与denosumab在治疗期间具有类似的作用机制和效果。
安全性(Safety)结果
不良事件(Adverse Events, AEs):MW032和denosumab的安全性概况相似,两组中报告的治疗相关不良事件的类型和频率没有显著差异。最常见的不良事件包括低钙血症(hypocalcemia)、低磷血症(hypophosphatemia)和高尿酸血症(hyperuricemia)。
严重不良事件(Serious Adverse Events, SAEs):两种治疗组中严重不良事件的发生率也相似,没有发现新的安全性问题或不良反应模式。
人群药代动力学(Population Pharmacokinetics)结果
药代动力学参数(Pharmacokinetic Parameters):MW032与denosumab在主要药代动力学参数,如最大血药浓度(Cmax)、药物暴露度(area under the curve, AUC)等方面表现出相似性。这些结果支持了MW032在体内的行为与denosumab相似,说明其可能具有相似的作用机制和效果。
骨相关事件(Skeletal-Related Events, SREs)结果
SREs发生率:在研究期间,MW032组和denosumab组的骨相关事件发生率相似,进一步证实了MW032在预防骨相关并发症方面与denosumab具有相似的效力。
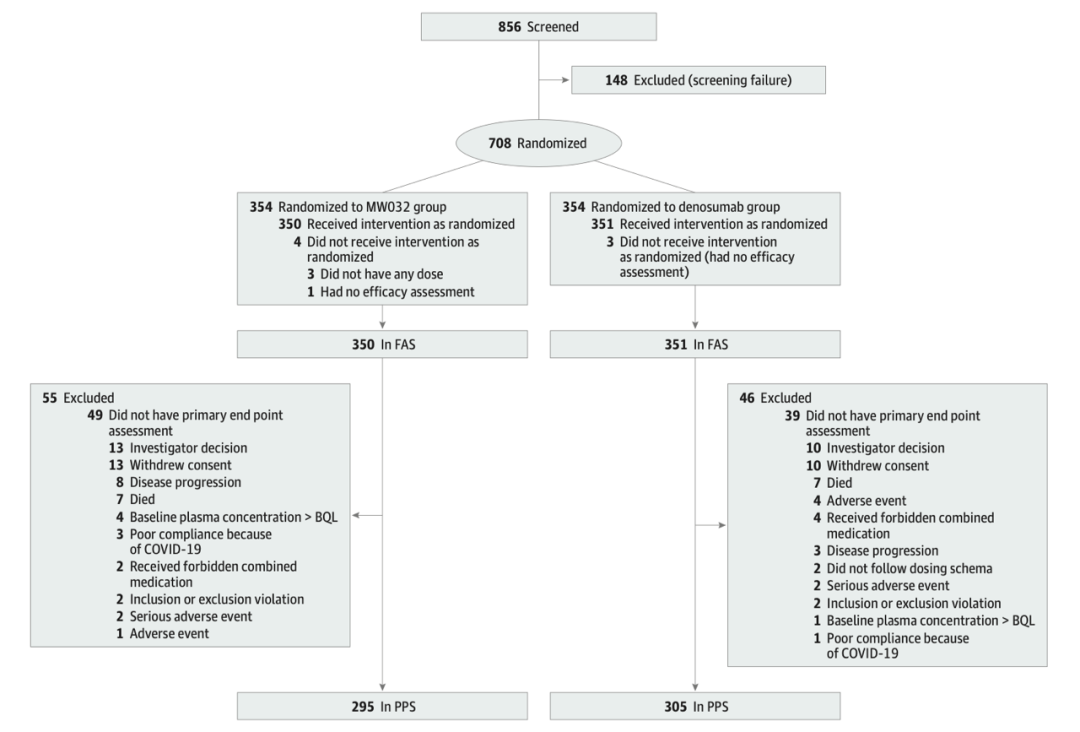
试验流程图(Credit: JAMA ONCOLOGY)
Prospects
长期疗效和安全性:研究期限为53周,对于评估长期疗效和安全性而言可能仍不充分。长期跟踪研究能够提供更多关于持续使用MW032后可能出现的不良反应或疗效持续性的信息。
特定人群的效果:研究中虽然包含了不同类型实体瘤的患者,但对于某些特定人群,如不同肿瘤亚型、不同遗传背景或具有特定并发症的患者,MW032的效果可能需要进一步评估。
与其他治疗方法的比较:除了与denosumab的直接比较外,未来研究中MW032与其他骨转移治疗方案,如双磷酸盐(bisphosphonates)等的比较,将有助于更全面地评估其在综合治疗策略中的地位。
经济性评估:虽然生物仿制药的开发旨在降低治疗成本,但关于MW032在实际医疗环境中的经济性评估,包括成本效益分析(cost-effectiveness analysis)和预算影响分析(budget impact analysis),仍需进一步研究。
生物标志物的应用:研究中使用了尿液N-端肽/肌酐比率(uNTx/uCr)作为主要疗效评估指标,未来研究可以探讨更多潜在的生物标志物,以便更精确地监测治疗效果和早期预测疗效。
不同治疗间隔和剂量的效果:研究中采用了每4周一次的给药方案,未来研究可以探索不同的治疗间隔和剂量对疗效和安全性的影响,以寻找最优化的治疗方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


