Nature子刊:南京大学陶云龙等首次实现人多能干细胞生成蓝斑去甲肾上腺素神经元
来源:生物世界 2023-11-20 16:07
威斯康辛大学麦迪迅分校张素春教授、南京大学陶云龙博士等在 Nature Biotechnology 期刊发表了题为:Generation of Locus Coeruleus Norepinephri
威斯康辛大学麦迪迅分校张素春教授、南京大学陶云龙博士等在 Nature Biotechnology 期刊发表了题为:Generation of Locus Coeruleus Norepinephrine Neurons from Human Pluripotent Stem Cells 的研究论文。
该研究揭示了人类蓝斑去甲肾上腺素能神经元发育过程中的关键信号通路,并在此发现的基础上实现了其体外的高效分化。
该研究成果为去甲肾上腺素能神经元的相关研究提供了良好的模型,使我们有机会进一步理解它在相关神经系统疾病中的作用,也让开发药物治疗相关疾病成为可能。

蓝斑核(Locus coeruleus,LC),简称蓝斑,是位于后脑第四脑室底,脑桥前背部,主要由去甲肾上腺素能神经元(Norepinephrine neuron,NE)组成的神经核团。它是中枢神经系统中合成去甲肾上腺素的主要部位,参与许多重要的生理功能如觉醒,清醒,应激反应,注意力集中,记忆及应激反应等。蓝斑去甲肾上腺素能神经元,与中脑黑质多巴胺神经元类似,因含有神经黑色素(neuromelanin)从而使其呈现出肉眼可辩的颜色。
蓝斑虽在大脑中具有十分重要功能,但其所含的神经元数量却非常少。如非人类灵长类的蓝斑仅含有10000-30000个去甲肾上腺素能神经元;在人类大脑中,这一数量为20000-50000。虽数量较少,蓝斑去甲肾上腺素能神经元却可以通过大量的神经元轴突分支投射到几乎整个大脑中,参与众多脑区的功能调节。
蓝斑去甲肾上腺素能神经元的功能异常与众多神经系统疾病有着密切的关联。例如,在患有神经退行性疾病如老年痴呆症及帕金森病的病人中,蓝斑是出现神经元退行性死亡的最早核团之一;另外,蓝斑去甲肾上腺素能神经元病变还与焦虑、抑郁、Rett综合症等神经疾病有关。
然而,目前我们对于蓝斑去甲肾上腺素能神经元在这些神经系统疾病中的具体功能依然知之甚少,其中一个最重要的原因是缺乏合适的细胞模型,可以让我们在体外模拟人类的去甲肾上腺素能神经元。通过从人多能干细胞(Pluripotent stem cell,PSC)分化得到真正、可靠的去甲肾上腺素能神经元理论上可以有效地解决这一困境。但由于前期对人类蓝斑去甲肾上腺素能神经元发育过程的研究较少,我们对其发育过程中的命运调控机制还不甚了解,导致其体外分化的系统至今尚未实现,严重制约了相关领域的研究进展。
早期的动物研究表明,蓝斑发育起源于第一个菱脑原节(Rhombomere 1,R1)的背侧。该区域的神经上皮细胞在发育过程中可进一步分化成一系列脑组组包括小脑,蓝斑等。研究人员假定人类的蓝斑组织和其他脊椎动物一样具有相似的发育途径。因此为了相应地得到人类的蓝斑组织细胞,研究人员首先需要将人多能干细胞分化成具有第一个菱脑原节身份的神经上皮细胞。已有的研究表明WNT信号通路的活性可以调控神经管从前端(前脑)至后端(后脑及脊髓)的区域化,通过调控WNT信号通路的活性可以有效、精准地将多能干细胞分化成具有特定区域身份神经上皮细胞。研究人员首先基于此策略成功得到了R1区域的神经上皮细胞,然而,当研究人员进一步检测与去甲肾上腺素能神经元发育有关的标记蛋白(ASCL1、PHOX2B)时,却发现非常少的细胞表达此类蛋白,也即表明R1神经上皮细胞中含有的去甲肾上腺素能神经祖细胞非常少,去甲肾上腺素能神经细胞的发育需要额外的信号才能完成由R1细胞到其祖细胞的特化(specification)。
为了找到影响人类去甲肾上腺素能神经元发育的关键信号,研究人员大量筛选了那些在动物体内对去甲肾上腺素能神经元发育过程中起重要作用的信号通路如BMP、FGF等,但却没有发现它们对人类去甲肾上腺素能神经元有任何正面作用,其中BMP信号通路反而明显地抑制了去甲肾上腺素能神经祖细胞的产生。
幸运的是,在大量筛选之后研究人员意外地发现ACTIVIN A可以有效地诱导去甲肾上腺素能神经组细胞的产生。正是基于这一全新的发现,研究人员终于找到了可以正向将R1神经上皮细胞特化成去甲肾上腺素能神经祖细胞的方法。进一步的研究表明ACTIVIN A 对于去甲肾上腺素能神经祖细胞的诱导作用具有区域特异性,即只有R1区域的神经上皮细胞才对ACTIVIN A 的处理有反应,而其他区域的神经上皮细胞是不能产生去甲肾上腺素能神经祖细胞,这一特性与蓝斑细胞的起源高度一致。除此之外,ACTIVIN A 对去甲肾上腺素能神经祖细胞的诱导也具有剂量及时间依赖性。
通过ACTIVIN A信号通路可以调控去甲肾上腺素能神经元发育这一发现,研究人员最终实现了去甲肾上腺素能神经元的体外高效分化。分化得到的去甲肾上腺素能神经元具有与体内去甲肾上腺素能神经元相似的特征如生产、释放和回收去甲肾上腺素神经递质,大量的轴突分支,CO2感应等。这一系列去甲肾上腺素能神经元特有的特征进一步表明多能干细胞分化的细胞是有功能的去甲肾上腺素能神经元。
为了进一步验证多能干细胞分化的去甲肾上腺素神经细胞,研究人员开展了多时间点的单细胞测序实验,动态地分析了处于分化中的细胞组成及其分化途径,证实了去甲肾上腺素神经细胞表达分子标记物及其比例。另外与体内组织的单细胞数据比较,研究人员发现,去甲肾上腺素神经细胞的基因表达与胚胎期小鼠蓝斑区域的细胞高度相似,进一步验证了该细胞类型。
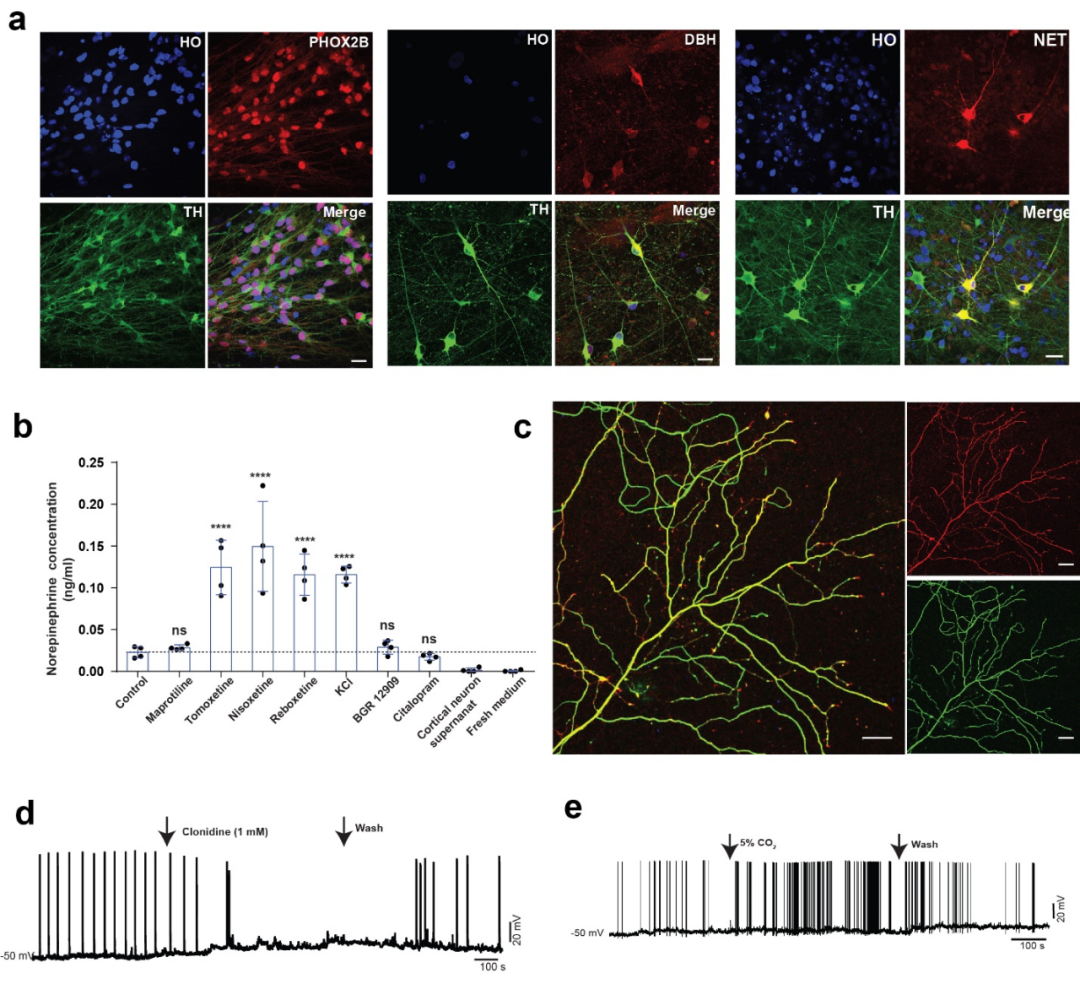
图1:由人多能干细胞分化得到去甲肾上腺素神经元具有多种该神经元所特有的特征
为了展示多能干细胞分化得到的去甲肾上腺素能神经元的应用,研究人员通过基因编辑技术将可以感应去甲肾上腺素神经递质的基因(NE sensor)插入到人多能干细胞的基因组中,再通过去甲肾上腺素能神经元体外的分化方法得到可以同时生产、释放、回收以及检测去甲肾上腺素的神经元。这一细胞平台可以用于筛选药物来治疗那些由于去甲肾上腺素神经递质发生紊乱而导致的神经系统疾病(抑郁等)。为了验证这一设想,研究人员使用目前在市场用于治疗抑郁的药物进行了测试,发现靶向去甲肾上腺素神经递质的重回收过程的药物可以显著提高NE sensor的信号强度,而那些靶向多巴胺或血清素神经递质的药物却对NE senor没有明显影响。这些结果表明该药物筛选平台可以用于高通量地寻找靶向调控去甲肾上腺素神经递质的新型药物。
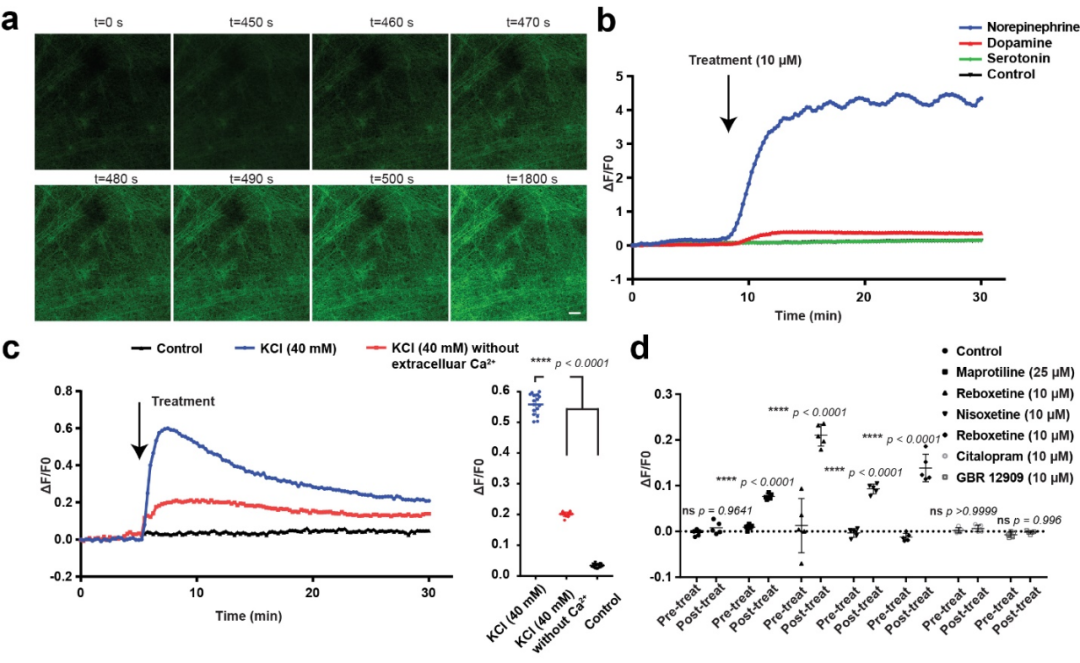
图2:利用人多能干细胞分化的去甲肾上腺素能神经元开发药物筛选平台
南京大学生命科学学院及化学和生物医药创新研究院双聘博士生导师陶云龙研究员为论文第一作者兼共同通讯作者,威斯康辛大学麦迪迅分校张素春教授为论文的共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


