JITC:把TMB的“门槛”抬高,才能找到从免疫治疗中长久获益的肺癌患者!
来源:奇点糕 2023-02-14 17:09
本次真实世界分析为肺癌免疫治疗中应用TMB指导用药,提供了非常好的证据,尤其是抬高TMB的Cut-off值结合PD-L1高表达,能识别出获益显著的患者群体,期待未来能有前瞻性研究对结论进一步验证
自从2012年PD-1抑制剂初战告捷,对晚期非小细胞肺癌(NSCLC)显示出疗效以来,肺癌免疫治疗走过了无比辉煌的十年,从无到有的问题早就解决,而覆盖肺癌全病程、惠及更多患者的目标也即将实现。
那么接下来摆在科学家和医生们面前的问题,就是如何让免疫治疗更精准,帮助更多患者持久获益和长期生存,单靠PD-L1表达水平还不足以做到这一点,而已经被广泛使用的肿瘤突变负荷(TMB),或许在这方面还有更多可挖掘的潜力。
近期在Journal of ImmunoTherapy for Cancer期刊上,来自美国多个机构的研究者们就发表了一项指导TMB应用的大样本真实世界分析,建议以20 muts/Mb作为NSCLC一线免疫治疗中,判定患者为高TMB的Cut-off值[1]。
在2165例接受免疫一线治疗的患者中,无论采用免疫单药还是免疫+化疗方案,TMB≥20 muts/Mb的患者都获益突出,真实世界中位无进展生存期(rwPFS)和总生存期(rwOS)是TMB<10 muts/Mb患者的2倍以上;而既是PD-L1高表达又是高TMB的患者预后更好,提示了同时检测PD-L1表达和TMB的必要性。

论文首页截图
用生物标志物预测NSCLC免疫治疗的预后和指导用药,一直都是热门课题,奇点糕们也没少介绍近年来学界提出的新型生物标志物,但还基本没有新标志物真正跨过转化关,应用到日常临床诊疗中。
而TMB则是已得到随机对照临床研究证实效能,也有监管部门和权威指南共识背书的生物标志物,但既往以10 muts/Mb作为Cut-off值时,TMB的表现却有些“起伏不定”,并不能适用于所有免疫治疗方案。
因此近年来有回顾性分析认为,应该把高TMB的Cut-off值设置得更高(19 muts/Mb),这样更有利于识别出免疫细胞浸润和炎性T细胞应答更高的肿瘤,从而筛选对免疫治疗应答更好的患者[2]。
本次研究则是从真实世界出发,寻找能够从一线免疫治疗中持久获益的NSCLC患者,评估治疗获益是否与更高的TMB水平相关,研究者们共纳入了2165例符合条件的患者,其中846例接受免疫单药治疗,1319例接受免疫+化疗一线治疗。
共有150例患者的rwPFS超过了24个月,被研究者定义为持久获益患者,从基线特征来看,持久获益患者整体的TMB和PD-L1表达水平显著更高,且有1/4(25.3%)的患者TMB≥20 muts/Mb,比例明显高于未能持久获益的患者(8.5%)。

表1.持久获益患者和其它患者的PD-L1表达、TMB水平对比
结合患者的治疗方案,研究者们进一步分析了将Cut-off值改为20 muts/Mb时,高TMB患者在真实世界中的预后:
在接受免疫单药治疗(ICPI)的患者中,TMB≥20 muts/Mb患者的中位rwPFS为17.2个月,显著优于TMB<10 muts/Mb患者的6.5个月(HR=0.53),中位rwOS分别为26.9个月和10.1个月,也呈显著优势(HR=0.54);
接受免疫+化疗(ChemoICPI)的患者中,TMB≥20 muts/Mb患者的中位rwPFS和rwOS分别为22.6个月和23.6个月,同样均显著优于TMB<10 muts/Mb的患者(7.1个月和10.7个月,HR=0.48/0.52)。
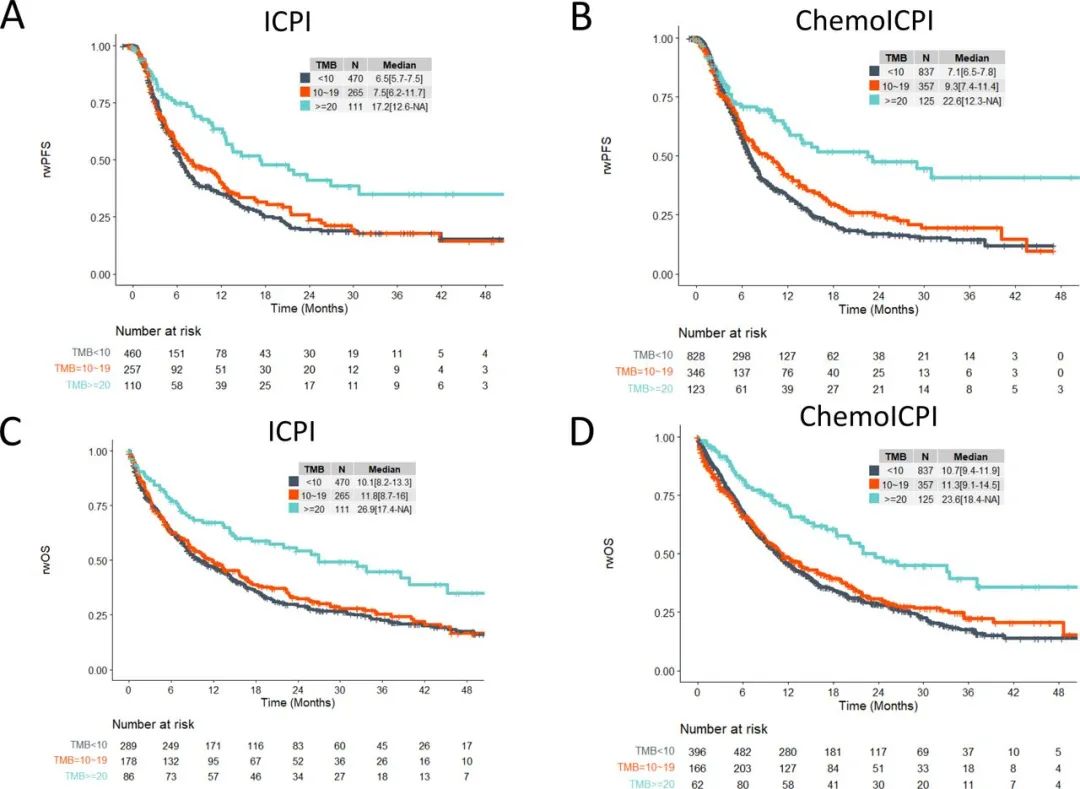
TMB≥20 muts/Mb患者的rwPFS和rwOS相对更优
而将改进后的高TMB与PD-L1高表达(肿瘤细胞分数≥50%)联合使用,可能在筛选患者时效果更好,这两种生物标志物“双阳性”人群的中位rwPFS和rwOS分别高达21.9和32.4个月,预后显著优于双阴性人群。
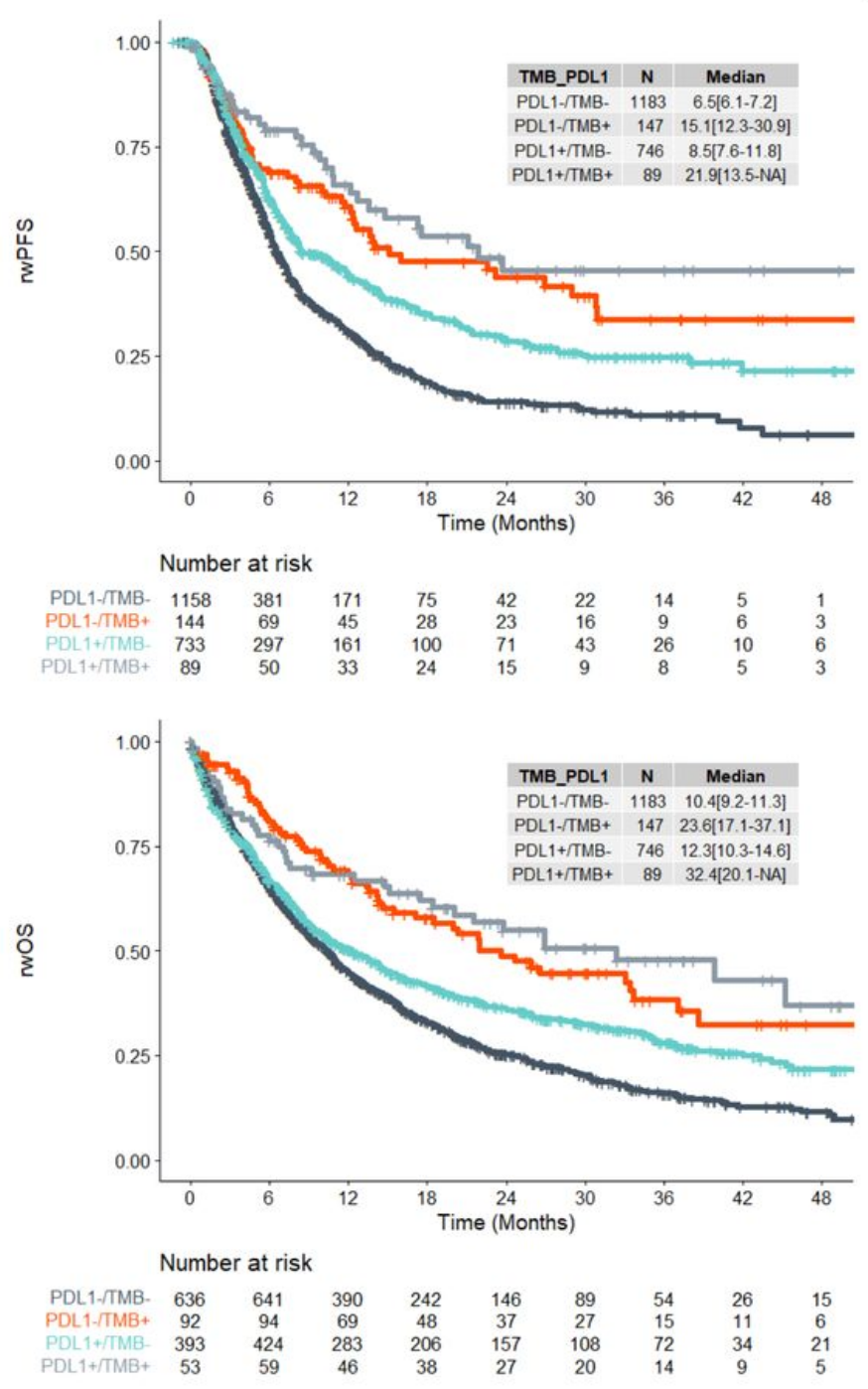
“双阳性”患者的预后更好
此外分析数据还显示,对TMB<20 muts/Mb且PD-L1低表达(1-49%)的患者,一线使用免疫+化疗患者的真实世界预后更好,这也与当前国内外指南推荐相符;而TMB≥20 muts/Mb且PD-L1高表达的患者,接受免疫单药或免疫+化疗的预后并无明显差异,这部分患者是否能够“免化疗”仍需进一步临床探索。
本次真实世界分析为肺癌免疫治疗中应用TMB指导用药,提供了非常好的证据,尤其是抬高TMB的Cut-off值结合PD-L1高表达,能识别出获益显著的患者群体,期待未来能有前瞻性研究对结论进一步验证,让免疫治疗这把利刃更加锋锐。
参考文献:
[1]Huang R S P, Carbone D P, Li G, et al. Durable responders in advanced NSCLC with elevated TMB and treated with 1L immune checkpoint inhibitor: a real-world outcomes analysis[J]. Journal for ImmunoTherapy of Cancer, 2023, 11(1): e005801.
[2]Ricciuti B, Wang X, Alessi J V, et al. Association of high tumor mutation burden in non–small cell lung cancers with increased immune infiltration and improved clinical outcomes of PD-L1 blockade across PD-L1 expression levels[J]. JAMA Oncology, 2022, 8(8): 1160-1168.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


