柳叶刀子刊:构建卵巢癌诊断人工智能融合模型
来源:中山大学 2024-01-20 15:10
卵巢癌早诊困难,研究团队让“小检验”发挥“大作用”。
近日,中山大学肿瘤防治中心妇科刘继红教授团队,联合南方医科大学、华中科技大学同济医学院附属同济医院、浙江大学医学院附属妇产科医院的合作者团队,在《柳叶刀·数字健康》(The Lancet Digital Health)发表了题为《使用实验室检验的人工智能模型准确诊断卵巢癌:一项中国的多中心、回顾性队列研究》的研究成果。
针对卵巢癌目前早期诊断困难、缺乏有效肿瘤标志物的困境,研究团队基于常规体检中的实验室检验构建了卵巢癌诊断人工智能融合模型,为卵巢癌提供了一种低成本、易获取,且高准确率的辅助诊断工具,有望助力卵巢癌的精准防控及早期诊断。

模型示意图
卵巢癌是致死率最高的妇科恶性肿瘤,其5年生存率仅为40%。卵巢癌发病隐匿,无特异性的症状体征,超过一半的患者发现已是晚期,这是卵巢癌预后差的重要原因。目前,临床上运用的主要卵巢癌标志物为糖类抗原125(CA125)和人附睾蛋白4(HE4),研究已证实其敏感性和特异性有限。总的来说,当前缺乏标志物实现卵巢癌的早期诊断,亟需发展新的卵巢癌诊断标志物协助卵巢癌诊断走出困境。
常规实验室检验(包括血常规、生化检查、凝血检查、尿液检查等)是临床和体检中最常用的检查项目。既往研究已证明,部分常见检验项目,如血液中的白蛋白浓度、血小板计数、中性粒细胞计数等,与卵巢癌的诊断和预后显著相关,提示这些常规检验指标具有成为卵巢癌标志物的潜力。这些标准化的实验室检验方法,检验成本低,已广泛运用于常规体检和各级医疗机构中。若能以这些检验指标作为标志物,对提高体检机构和基层医疗机构的卵巢癌诊断水平,改善疾病二级预防现状,进而改善卵巢癌患者的预后具有重要意义。
创新构建卵巢癌预测模型,精准锁定风险人群
研究者共收集了中山大学肿瘤防治中心、华中科技大学同济医学院附属同济医院、浙江大学医学院附属妇产科医院超过1万例女性的98项实验室检查结果,并基于团队自主研发的创新人工智能融合框架——MCDM框架,融合20个人工智能基分类模型,构建了卵巢癌预测模型——MCF模型。该模型最终纳入51项实验室检验指标和年龄,其在内部验证集和两个独立的外部验证集上的AUC分别达0.949(95%CI 0.948-0.950)、0.882(0.880-0.885)和0.884(0.882-0.887)。
研究结果显示,MCF模型识别卵巢癌患者、特别是早期卵巢癌患者的AUC和灵敏度显著高于传统卵巢癌标志物CA125、HE4及两者联合,且在部分指标缺失的人群中依然可以对卵巢癌的风险进行较准确的预测,提示MCF模型具有较好的稳定性,并对真实世界数据具有较好的兼容性。
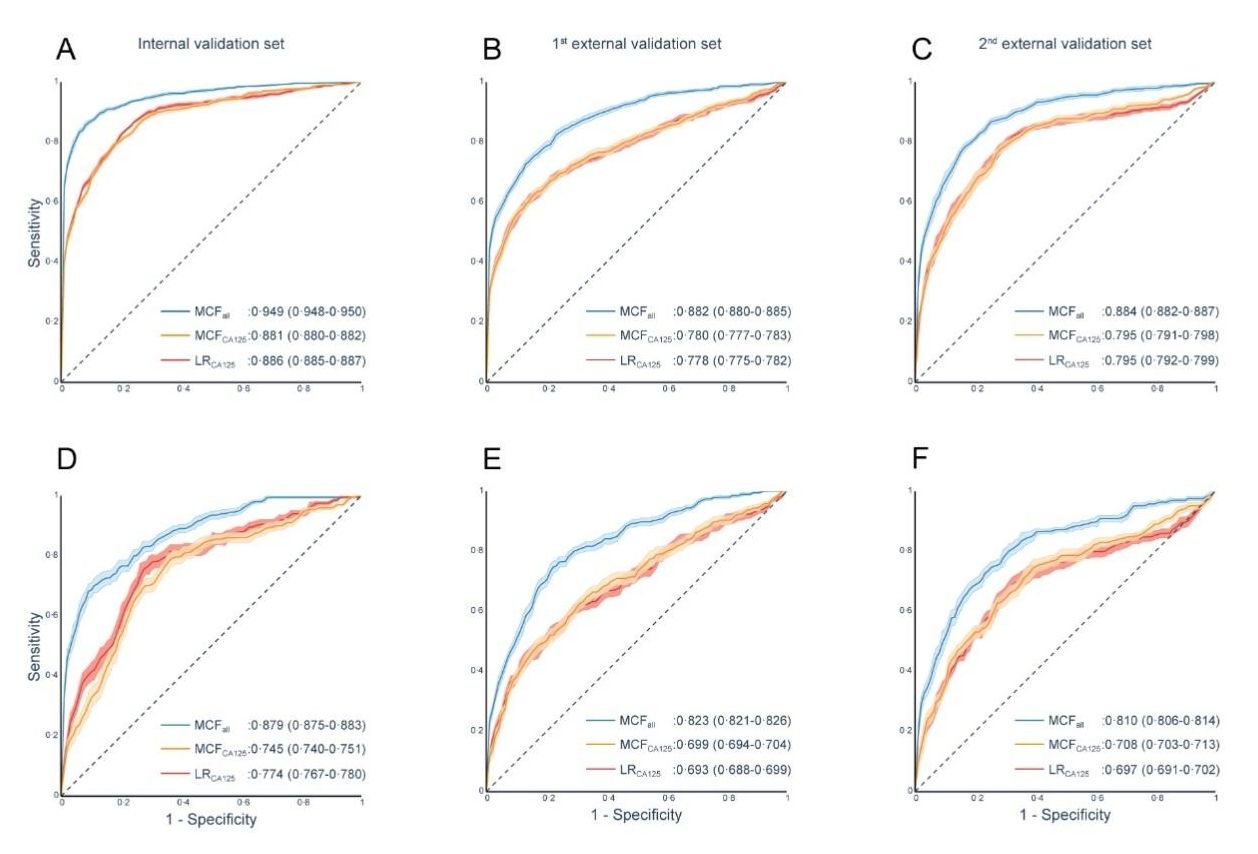
模型对比CA125对卵巢癌(图A-C)、早期卵巢癌(D-F)的诊断效能
该研究为卵巢癌提供了一种低成本、易获取,且准确的人工智能辅助诊断工具——MCF模型。由于模型使用的所有特征均为常规实验室项目,故在体检机构或对妇科肿瘤经验有限的基层医疗机构中,该模型可为卵巢癌的诊断提供宝贵且高效的决策帮助。
本研究构建的MCF模型已封装为开源的卵巢癌预测工具,输入相应实验室检验数据和年龄即可计算患卵巢癌的风险值。此外,本研究还发现,除肿瘤标志物外,其他常规实验室检验,如D-D二聚体、血小板计数等,也对卵巢癌诊断预测有较大贡献,提示这些检验指标相关病理生理过程可能在卵巢癌的发展过程中发挥了重要作用,其潜在机制值得进一步探讨。
中山大学肿瘤防治中心蔡光瑶博士、南方医科大学博士研究生黄方俊、华中科技大学同济医学院附属同济医院高越博士、浙江大学医学院附属妇产科医院李晓教授为本文共同第一作者;中山大学肿瘤防治中心刘继红教授、南方医科大学甄鑫教授、华中科技大学同济医学院附属同济医院高庆蕾教授为共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


