突破肌肉再生瓶颈!Nat Biotechnol:类器官培养促进小鼠成肌细胞去分化为肌肉再生的干细胞
来源:生物谷原创 2024-09-26 14:34
本研究开发了一种从肌肉组织生成体外衍生卫星细胞(idSCs)的方法,这些细胞在小鼠体内移植后能够有效支持肌肉再生并恢复肌肉功能。
卫星细胞是负责肌肉生长和再生的干细胞。在肌肉损伤后,卫星细胞可以激活并分化成肌母细胞,后者进一步形成肌纤维。然而,卫星细胞稀少且难以大量获取,目前还没有有效的方法在体外扩增并保持其干细胞特性。
近日,哈佛大学Lee L. Rubin研究团队在Nat Biotechnol上发表了题为“Organoid culture promotes dedifferentiation of mouse myoblasts into stem cells capable of complete muscle regeneration”的研究论文,提出了一种从骨骼肌组织生成体外衍生卫星细胞(idSCs)的方法。研究结果表明,idSCs可能为治疗遗传性肌肉疾病、创伤引起的肌肉损伤和与年龄相关的肌肉无力提供可扩展的细胞来源。

研究表明,在三维培养条件下,肌母细胞可以逆转为卫星细胞样状态。卫星细胞通过表达转录因子Pax7来维持干细胞特性,而肌母细胞则通过激活MyoD进行分化并丧失干细胞潜能。将肌母细胞在旋转瓶中培养形成骨骼肌类器官(SkMOs),并调整培养条件,最终生成的SkMO细胞表现出肌球蛋白重链(MyHC)和Pax7的双重表达。
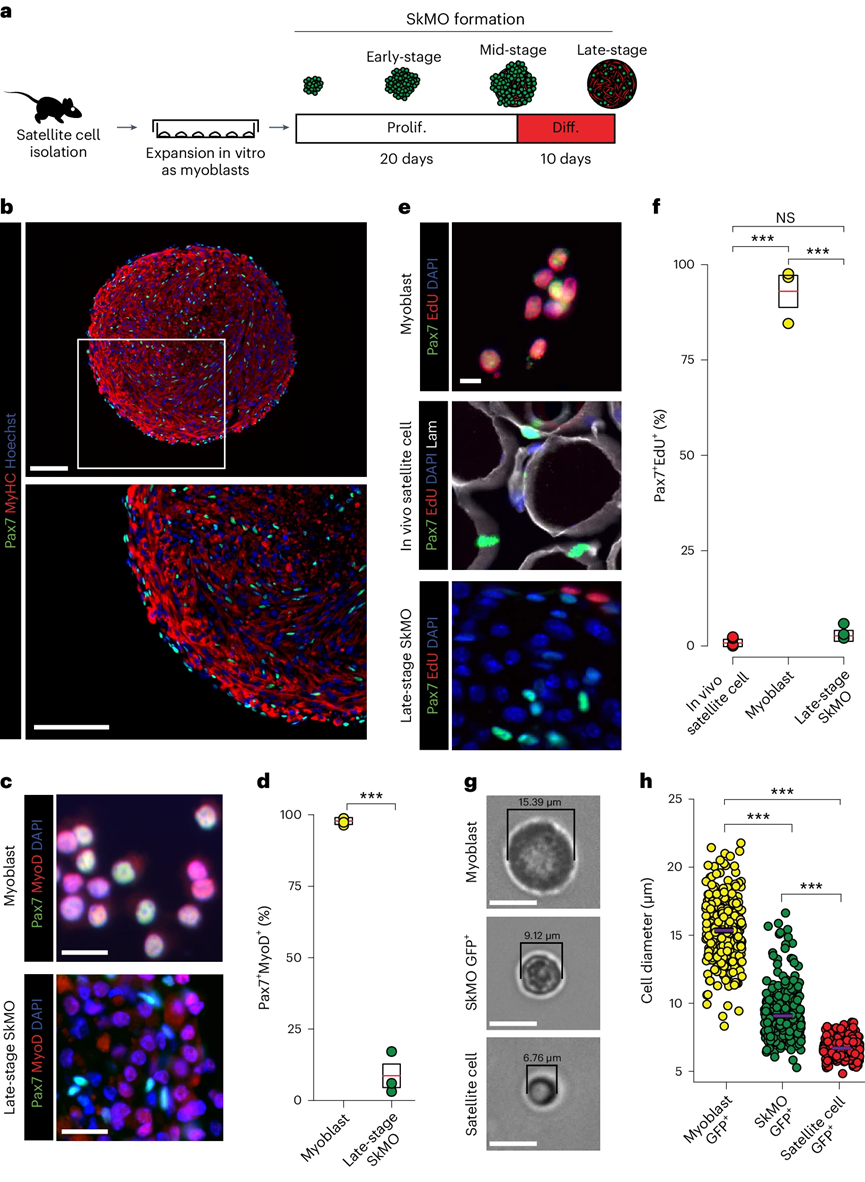
图 1:小鼠成肌细胞可以形成与卫星细胞具有共同体外特性的SkMO
验证idSCs的特性
使用转基因小鼠,研究验证了SkMO中的GFP+细胞具有类似卫星细胞的特征,包括静止状态、小细胞体积和克隆生长能力。这些SkMO衍生的GFP+细胞能够形成克隆,并在体外分化为多核肌管。最终,这些细胞被称为idSCs,展示了其在三维培养中重塑为卫星细胞的能力。
基因表达分析
通过多重RNA测序分析,研究比较了新鲜分离的卫星细胞、肌母细胞和体外生成的idSCs的转录特征。结果显示,idSCs在基因表达上与内源性卫星细胞相似,而与肌母细胞和储备细胞则明显不同。关键基因涉及Notch信号通路、早期应激反应、静止状态及细胞外基质等。
差异基因表达分析发现,idSCs与肌母细胞之间存在1,347个差异表达基因,idSCs与卫星细胞之间存在774个差异基因。功能富集分析显示,idSCs和卫星细胞共享并上调了多条与细胞粘附和细胞外基质相关的KEGG通路。相对而言,肌母细胞和idSCs在细胞周期和代谢通路中的激活水平较高,表明idSCs在转录特征上处于肌母细胞和卫星细胞之间的中间状态。
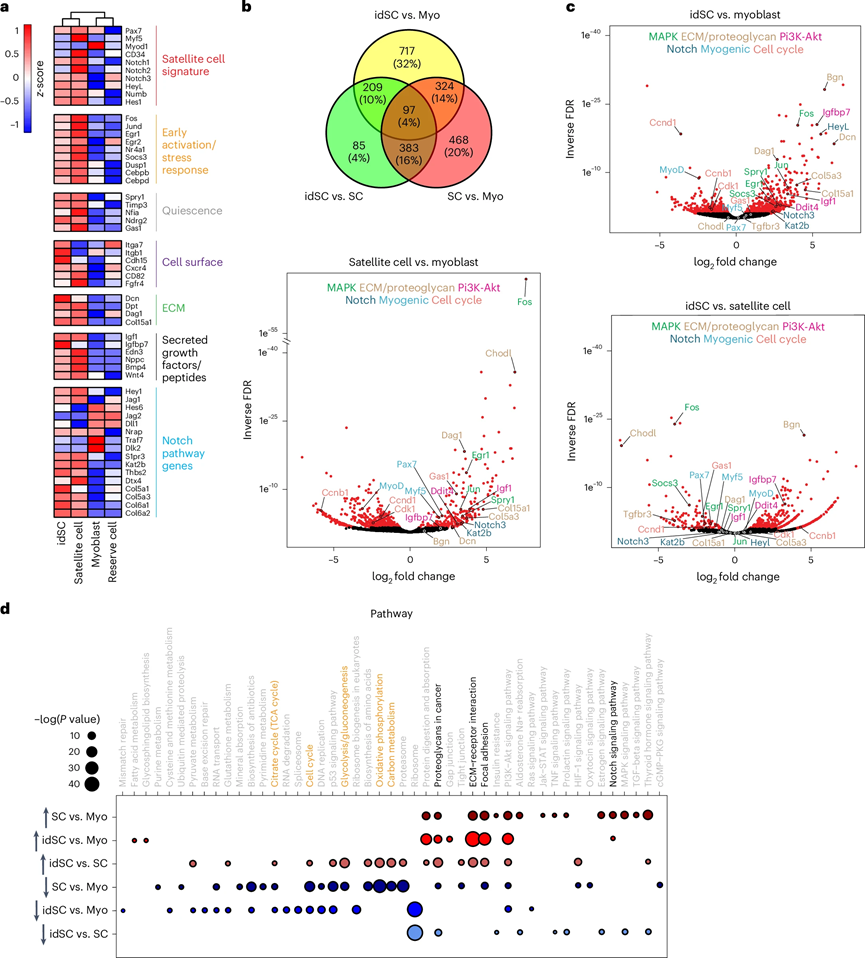
图 2:idSCs与卫星细胞具有关键的转录相似性
表观基因组动态变化
此外,本研究还探讨了肌母细胞在转化为卫星细胞样细胞(idSCs)时的表观基因组动态变化。
通过Omni-ATAC-seq分析在不同时间点(第10天、第20天和第30天)获得的idSC样本,研究共识别出约40,000个与肌肉发生相关的染色质区域。
结果显示,肌母细胞状态下的开放染色质区域在idSCs和卫星细胞中逐渐闭合,尤其在第30天的idSCs中。无偏聚类分析将这些染色质区域分为五个类群,涉及肌肉发育、细胞外基质(ECM)组织及细胞周期调节相关基因。
差异分析表明,idSCs在表观遗传特征上逐渐向卫星细胞转变,同时保留与ECM和肌动蛋白重塑相关的独特特征。
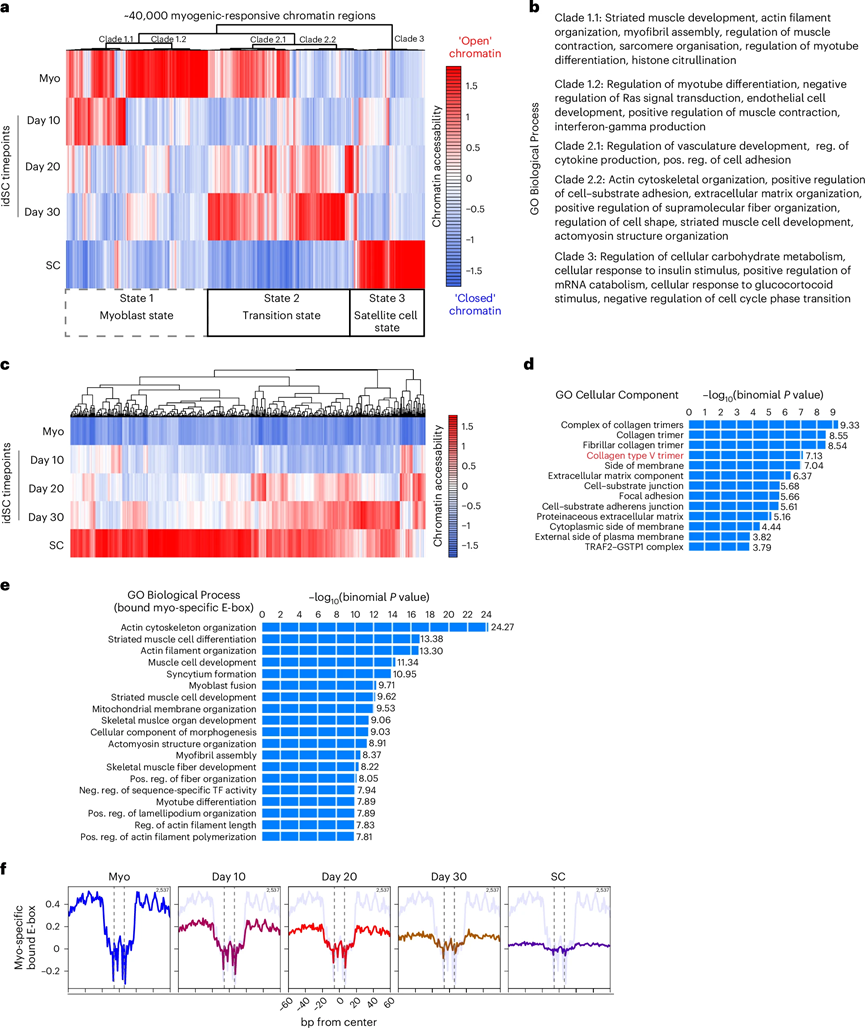
图 3:在idSC生成过程中,定义成肌细胞程序的关键调节区域被沉默
体内功能验证
研究还评估了idSCs在体内的功能。通过将晚期idSCs植入损伤肌肉中,评估其在体内的存活、整合和自我更新能力。研究使用表达荧光素酶和tdTomato的慢病毒感染肌母细胞,进行体内追踪和生物发光成像(BLI)。实验结果显示,idSCs在植入后具有显著的存活能力,体内辐射强度随时间显著增加,而肌母细胞的辐射强度逐渐降低。
21天后,idSCs在肌肉中的整合情况显著优于肌母细胞,表现为更多的tdTomato+肌纤维。idSCs还能有效填充卫星细胞小区,占卫星细胞的14%,而肌母细胞几乎未能生成Pax7+tdTomato+细胞。实验还表明,idSCs在经历多轮CTX损伤后仍能持续自我更新,支持肌肉再生。与新鲜分离的卫星细胞相比,idSCs在肌肉再生和卫星细胞小区再填充方面表现优越。
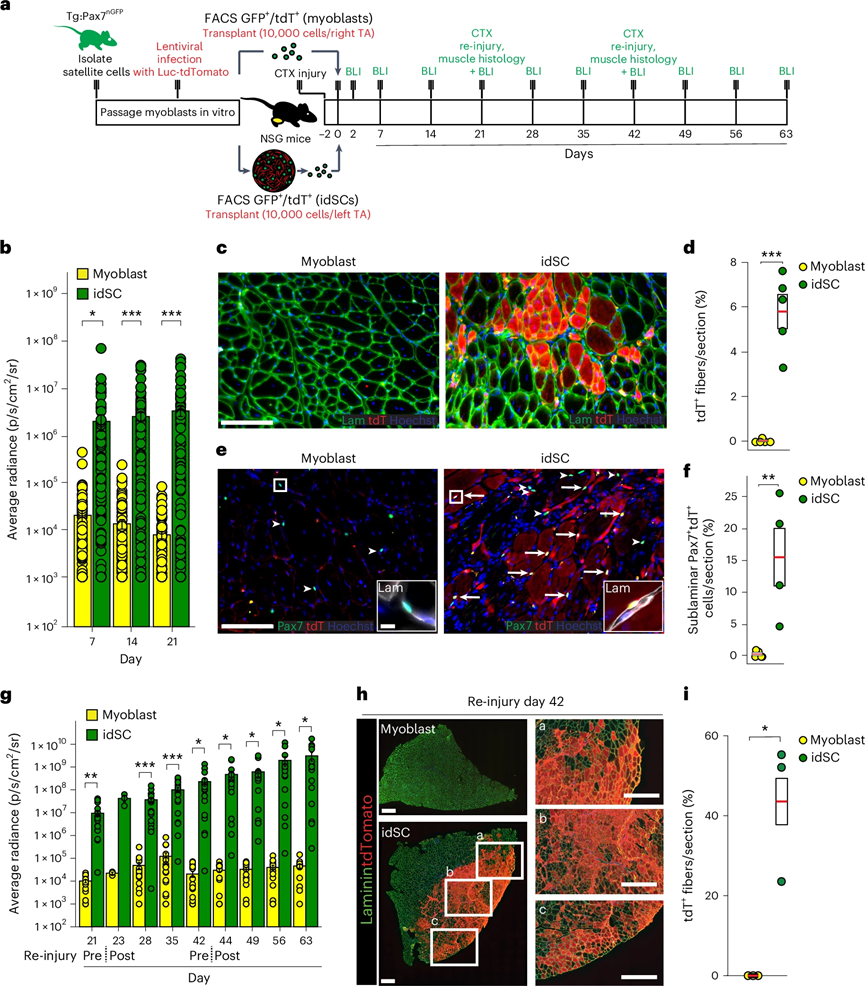 图 4:idSCs在体内移植、重新填充和自我更新
图 4:idSCs在体内移植、重新填充和自我更新
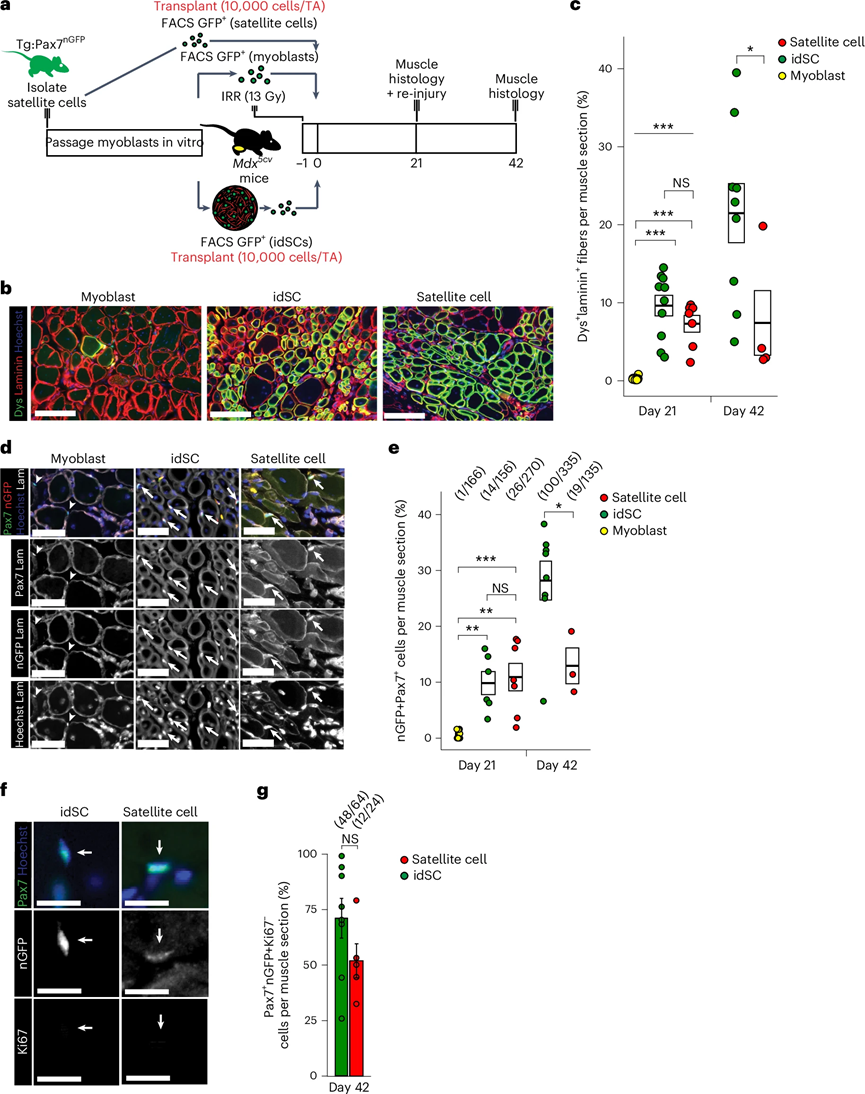
图 5:idSCs在抗肌萎缩蛋白缺陷小鼠模型中体内移植、重新繁殖和自我更新
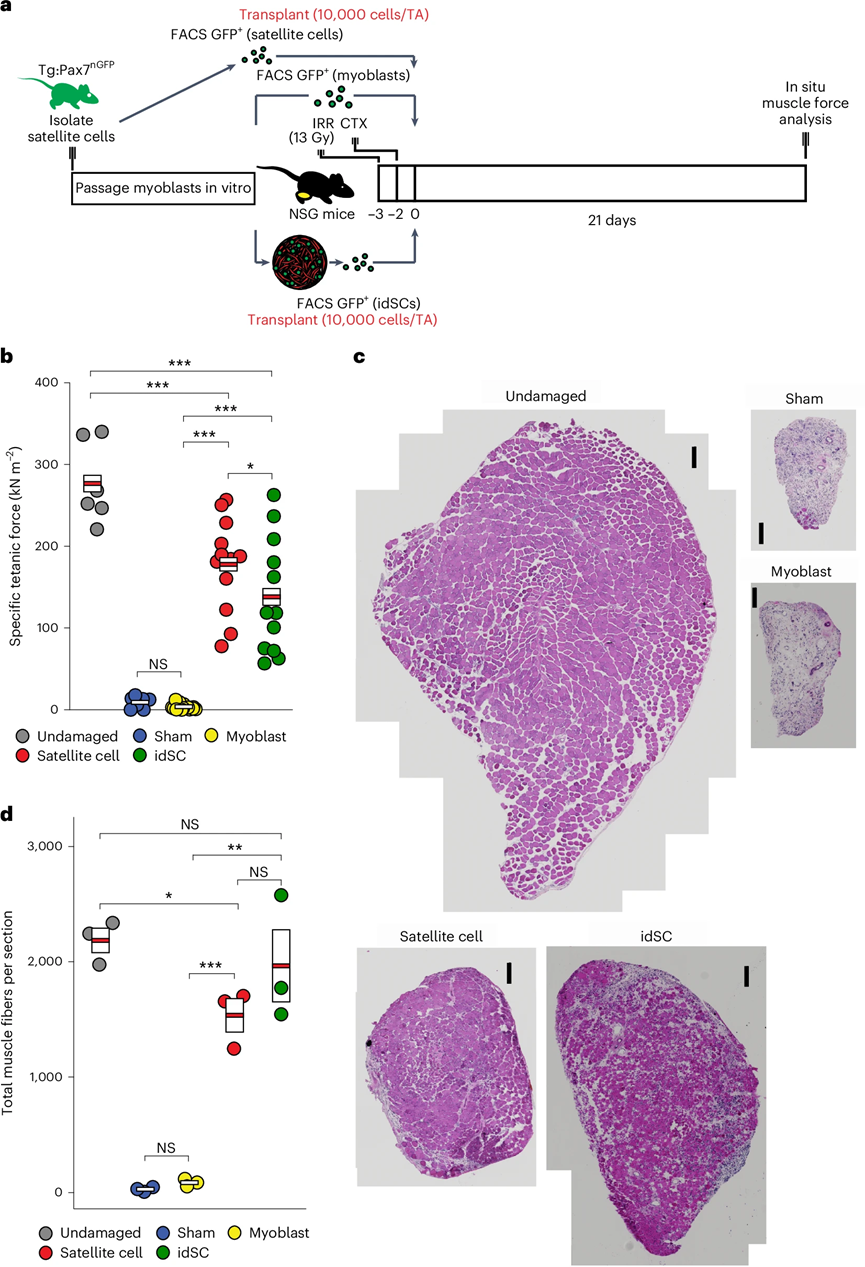
图 6:idSCs在移植到再生肌肉后产生功能性肌肉的能力与卫星细胞相似
人类细胞的应用
为了提高研究的临床相关性,研究人员从患者活检或商业来源获得人类肌母细胞,并在增强的无血清培养基中生成了人类骨骼肌类器官(SkMOs),整个培养过程缩短为15天。研究发现,在SkMO形成过程中,PAX7+细胞的比例从肌母细胞阶段的3.5%±3%降至5%±1%,且在SkMOs中,仅少数PAX7+细胞(5%±2%)同时表达MyoD(仅占84%±2%)。此外,从增殖的肌母细胞转变为SkMOs时,EdU+细胞比例显著下降,表明肌母细胞经历去分化,维持Pax7表达但缺失MyoD表达。
总结
总体而言,本研究开发了一种从肌肉组织生成体外衍生卫星细胞(idSCs)的方法,这些细胞在小鼠体内移植后能够有效支持肌肉再生并恢复肌肉功能。研究还揭示了idSCs的关键基因和信号通路,并成功从人类肌肉组织生成了类似卫星细胞的细胞,为肌肉疾病治疗提供了潜在应用。这一突破性的研究为未来肌肉疾病的治疗带来了新的希望。
参考文献:
Price, F.D., Matyas, M.N., Gehrke, A.R. et al. Organoid culture promotes dedifferentiation of mouse myoblasts into stem cells capable of complete muscle regeneration. Nat Biotechnol (2024). https://doi.org/10.1038/s41587-024-02344-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


