Nat Commun:科学家揭秘免疫系统中的“超级战士”为何会筋疲力尽?代谢不足竟是关键!
来源:生物谷原创 2025-03-21 10:26
本文研究结果不仅揭开了这一谜团,还为未来的治疗提供了新的方向。通过调节代谢途径或能让这些“超级战士”在感染和癌症治疗中发挥更大的作用,同时也为自身免疫疾病患者带来了新的希望。
当病毒或癌细胞入侵机体时,免疫系统会迅速启动防御机制,其中一种重要的武器就是I型干扰素(IFN-I);这种蛋白质不仅能帮助机体抵御病毒和癌症,还在自身免疫疾病中扮演着复杂的角色。然而尽管所有细胞都能产生少量的IFN-I,但有一种名为浆细胞样树突状细胞(pDCs)的细胞却以其卓越的IFN-I生产能力脱颖而出,其能在接触病原体后的几小时内产生多达1000倍的IFN-I亚型,因此其被称为人体中名副其实的“超级战士”。然而,这种强大的IFN-I爆发却只是昙花一现,在机体感染的后期和肿瘤环境中,pDCs的IFN-I生产能力会急剧下降。
免疫学家们一直致力于研究pDCs在感染初期的强烈IFN-I反应,但对于其为何在后期停止产生IFN-I及背后的机制却知之甚少。解开这一谜团对于利用pDCs的功能来治疗感染、癌症甚至抑制自身免疫疾病中的病理性IFN-I至关重要。
近日,一篇发表在国际杂志Nature Communications上题为“Metabolic deficiencies underlie reduced plasmacytoid dendritic cell IFN-I production following viral infection”的研究报告中,来自加州大学圣地亚哥分校等机构的科学家们通过研究揭示了pDCs在感染后被抑制的关键机制。文章中,研究人员首次发现,这种抑制与代谢不足密切相关,特别是与乳酸脱氢酶B(LDHB)的下调有关,LDHB是一种对代谢和能量产生至关重要的酶。
研究者指出,LDHB在pDCs介导的IFN-I生产中起着关键作用,其缺乏会限制宿主控制病毒感染的能力;更令人惊讶的是,恢复被抑制的pDCs中的LDHB表达足以改善IFN-I生产能力。这一发现表明,代谢是调节这种强大干扰素产生细胞的关键因素。研究者Zúñiga教授表示,代谢缺陷与病毒感染期间pDCs的自然抑制密切相关,这非常重要,因为这些细胞具有无与伦比的干扰素生产能力,这些能力在抗病毒防御和抗肿瘤免疫中至关重要,同时也在自身免疫疾病中发挥病理性作用。
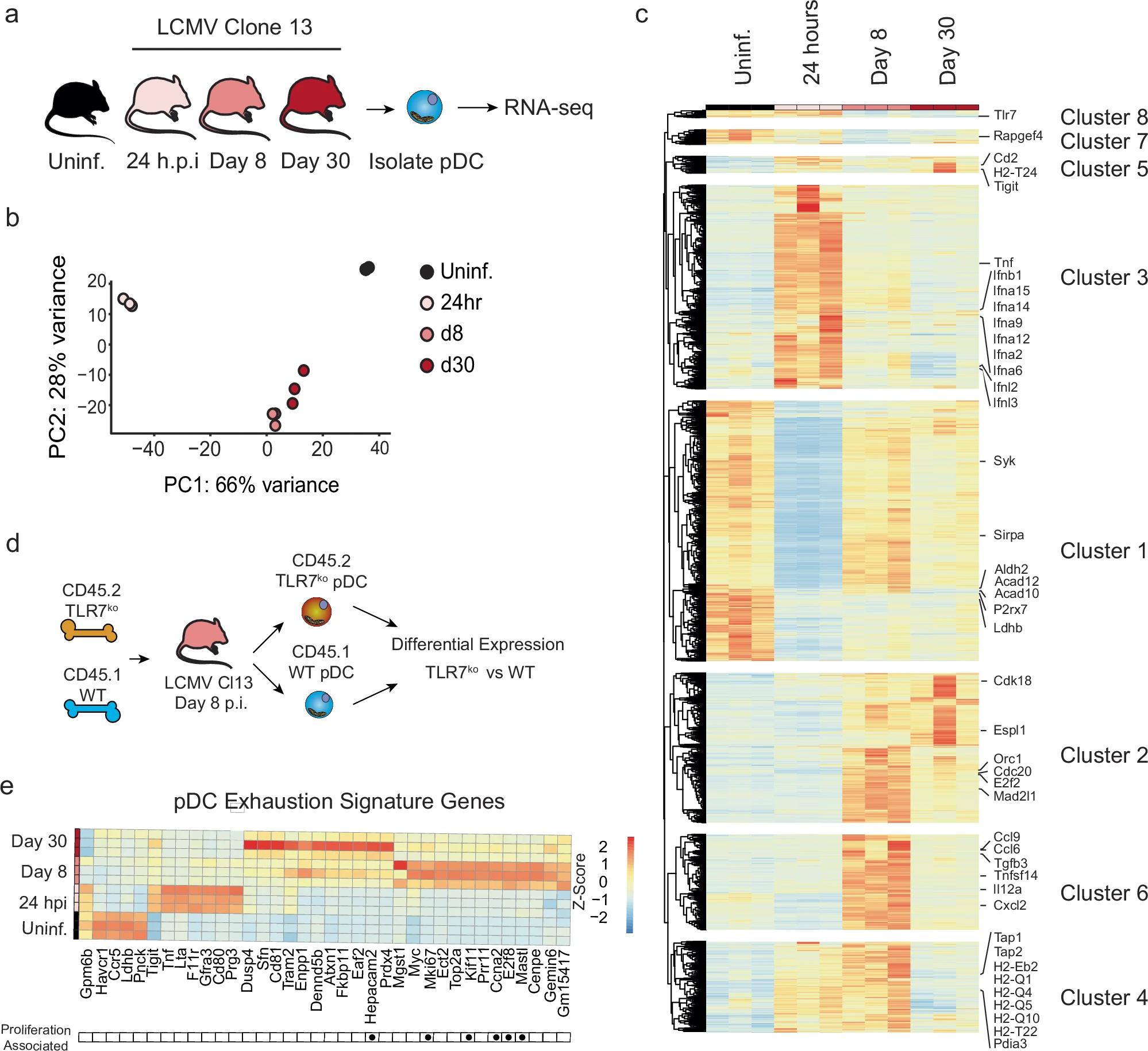
确定LCMV感染过程中pDCs的转录组学变化
诸如系统性红斑狼疮(SLE)等自身免疫疾病是一种复杂的免疫系统失调疾病,即机体免疫系统会错误地攻击自身健康组织,从而导致皮肤、关节、肾脏和神经系统等多个器官受损。目前,治疗这类疾病主要依赖免疫抑制药物,但这些药物往往伴随着严重的副作用。近年来,随着对免疫系统调节机制的深入研究,科学家们逐渐认识到,调节免疫系统而非简单抑制它,可能是治疗这些疾病的关键。为了研究pDCs在感染后的变化,研究人员对感染了淋巴细胞性脉络膜脑膜炎病毒(LCMV)的小鼠进行了实验,结果发现,在感染初期pDCs能够迅速产生大量IFN-I,但随着时间推移, IFN-I生产能力会逐渐下降。通过进行转录组学分析,研究人员发现,与代谢相关的基因在pDCs功能抑制过程中发生了显著变化,尤其是LDHB的表达会被下调。
进一步的实验表明,LDHB的缺乏不仅限制了pDCs的IFN-I生产能力,还会影响其代谢能力;随后,研究人员通过基因编辑技术将LDHB基因敲除的小鼠与野生型小鼠进行比较,结果发现,LDHB缺乏的小鼠在感染后表现出更严重的病毒控制问题;相反,通过恢复LDHB的表达就能成功改善被抑制的pDCs的功能。这项研究不仅揭示了pDCs在感染后期功能抑制的机制,还为开发新的治疗方法提供了可能;通过调节LDHB或相关代谢途径,研究人员或许有望增强pDCs的IFN-I生产能力,从而提高宿主对病毒感染和癌症的抵抗力;此外,这种方法或许也有助于限制自身免疫疾病中的病理性IFN-I产生并能减轻疾病症状。
研究者表示,针对LDHB等代谢途径的干预措施或能增强免疫系统对感染和癌症的防御能力,或许也能减轻自身免疫疾病中的病理反应,这一发现为开发新的治疗策略提供了重要的理论基础。作为免疫系统中的“超级战士”,pDCs在抗病毒和抗肿瘤免疫中发挥着不可替代的作用。然而其在感染后期的功能抑制一直是免疫学领域的未解之谜。
本文研究结果不仅揭开了这一谜团,还为未来的治疗提供了新的方向。通过调节代谢途径或能让这些“超级战士”在感染和癌症治疗中发挥更大的作用,同时也为自身免疫疾病患者带来了新的希望。(生物谷Bioon.com)
参考文献:
Greene, T.T., Jo, Y., Chiale, C. et al. Metabolic deficiencies underlie reduced plasmacytoid dendritic cell IFN-I production following viral infection. Nat Commun 16, 1460 (2025). doi:10.1038/s41467-025-56603-5
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


