研究揭示亚硝基化修饰调控哺乳动物蛋白质合成的速度与**性
来源:生物物理研究所 2020-06-05 12:21
6月3日,国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组、王恩多研究组与中科院生物物理研究所陈畅研究组合作的研究成果"Nitrosative stress inhibits aminoacylation and editing acti
6月3日,国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙研究组、王恩多研究组与中科院生物物理研究所陈畅研究组合作的研究成果"Nitrosative stress inhibits aminoacylation and editing activities of mitochondrial threonyl-tRNA synthetase by S-nitrosation"。
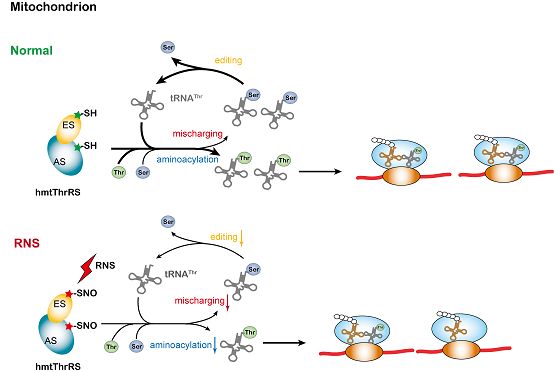
人基因组编码38种氨基酰-tRNA合成酶(aminoacyl-tRNA synthetase, aaRS),负责细胞质与线粒体两套蛋白质合成系统。aaRS催化tRNA的氨基酰化反应保证蛋白质合成的速度,催化编校反应保证蛋白质合成的精确性。蛋白质合成的速度与精确性受营养、环境、病原体感染等因素的调控。例如,在细菌感染时,人细胞质甲硫氨酰-tRNA合成酶(MetRS)被磷酸化修饰,误氨基酰化若干非tRNAMet,在非甲硫氨酸密码子上误参甲硫氨酸,介导适应性翻译(adaptive translation);在氧化应激(oxidative stress)条件下,细菌苏氨酰-tRNA合成酶(ThrRS)编校活性位点的半胱氨酸(Cys)会被次磺酸化修饰,导致编校活性丧失,造成错误翻译(mistranslation);沙门氏菌苯丙氨酰-tRNA合成酶(PheRS)在氧化应激情况下发生氧化修饰,却促进编校反应。但长期以来,硝化应激(nitrosative stress)对于蛋白质合成的潜在调节作用一直未知。
该项研究中,研究人员首先发现:活性氧H2O2引起的氧化应激不能调节人或鼠线粒体及细胞质ThrRS的活性;与之相反的是,活性氮(Reactive Nitrogen Species, RNS)一氧化氮供体GSNO却显着下调线粒体ThrRS的氨基酰化与误氨基酰化能力;通过自主优化的不可逆Biotin-Switch方法(Irreversible Biotin-switch Procedures, IBP),结合质谱分析,鉴定了线粒体ThrRS上4个Cys残基被亚硝基化修饰,其中一个残基(Cys409)是氨基酸活化的活性中心;通过一系列突变体的构建,结合生化分析,发现发生在每一个Cys残基的亚硝基化修饰均不同程度地下调了酶的氨基酰化与编校反应活力;进一步分别从人源细胞线粒体和小鼠皮层组织中鉴定到8种线粒体aaRS和14种细胞质aaRS被亚硝基化修饰。进一步研究发现在亨廷顿疾病(Huntington disease)小鼠模型中检测到皮层组织线粒体ThrRS亚硝基化修饰显着降低,提示线粒体蛋白质合成调控在疾病中的潜在作用。
该研究首次发现硝化应激对ThrRS氨基酰化与编校反应的抑制作用;首次绘制了人源细胞和小鼠皮层组织中细胞质与线粒体的aaRS亚硝基化修饰网络,揭示了亚硝基化修饰对哺乳动物细胞蛋白质合成的速度与精确性的调控;为揭示亨廷顿神经退行性疾病的分子机制提供了新的线索。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


