利什曼原虫胞外囊泡介导感染与免疫调控!mBio揭示寄生虫-宿主互作及诊疗新靶点机制
来源:生物谷原创 2025-10-10 12:28
利什曼原虫及其感染细胞释放的胞外囊泡可携带毒力因子、调节宿主免疫反应,为利什曼病的诊断与治疗提供新方向。
在全球寄生虫病谱里,利什曼病虽不如疟疾“声名远扬”,却悄无声息地威胁着数百万患者的健康——皮肤溃疡、内脏器官受损是它的典型“印记”。近日,mBio发表的一篇文章mGem: Extracellular vesicles in Leishmania-secret messengers driving infection and disease,聚焦利什曼原虫分泌的胞外囊泡(EVs),为我们解开这种寄生虫“操控”感染与疾病进程的机制,也点亮了诊疗的新希望。

利什曼原虫的生命周期复杂,在昆虫宿主中以“前鞭毛体”形式存在,进入人类等脊椎动物宿主后,会转化为“无鞭毛体”并寄生在吞噬细胞内。和其他真核生物一样,利什曼原虫及受其感染的细胞会释放EVs——这类由脂质双分子层包裹、不含复制元件的颗粒,能携带蛋白质、核酸、代谢物等活性分子,在细胞间“传递信号”,尤其在宿主与病原体的相互作用中左右疾病走向。EVs依据生成途径可分为外泌体、微囊泡(ectosomes)和凋亡小体三类,早有研究证实,利什曼原虫及其感染细胞分泌的EVs会参与宿主-病原体互作,推动疾病发生发展。
EVs是利什曼原虫“投放”毒力因子的核心载体。为了躲避免疫攻击、实现自身存活增殖,利什曼原虫进化出多种策略,释放EVs就是关键一招。质谱研究显示,利什曼原虫可通过EVs分泌蛋白质,外泌体更是它向宿主细胞递送蛋白的“通用通道”,且在受感染巨噬细胞的胞质中,能检测到利什曼原虫来源的EVs。尽管EVs的生物发生机制尚未完全阐明,但蛋白质组分析发现,其包含内体机制相关蛋白及内体分选复合物(ESCRT)通路成分——要知道,ESCRT通路正是外泌体生成和释放的“幕后推手”。
利什曼原虫来源的EVs中,藏着不少关键分子:毒力因子、细胞代谢蛋白、免疫介质等都在其中。比如虫体表面最丰富的蛋白gp63,它能帮原虫逃避补体溶解、降解胞外基质,还能抑制宿主细胞的p38-MAP激酶通路。含gp63的EVs在昆虫载体中也能被检测到,当原虫传播给脊椎动物宿主时,EVs会和原虫一同分泌;更关键的是,把利什曼原虫与虫源EVs一起接种,会让疾病变得更重——这说明感染初期的相互作用,EVs也“功不可没”。不过,目前多数研究聚焦体外培养的前鞭毛体EVs,沙蝇体内EVs的研究还很少,比如“体外EVs的携带物是否和自然感染沙蝇中的一致”“EVs是否参与沙蝇体内原虫的循环分化”等问题,还需要进一步探索。
除了蛋白质,利什曼原虫RNA病毒1(LRV1)也会“搭便车”EVs:EVs能作为病毒的“包膜”,帮助LRV1在不同原虫群体间传播,还能向脊椎动物宿主递送病毒。要知道,LRV1的存在会让利什曼病更严重,感染携带LRV1的利什曼原虫的患者,治疗失败的风险也更高。此外,利什曼原虫还能通过EVs交换耐药基因;至于其携带的非编码RNA(如rRNA、tRNA)是否能调节细胞信号或基因表达,也值得深入挖掘。
利什曼原虫来源的EVs,对宿主免疫细胞功能的影响同样显著。无鞭毛体是致病阶段,会寄生并增殖于巨噬细胞内,因此巨噬细胞对EVs的反应备受关注。当巨噬细胞暴露于利什曼原虫EVs时,会“上调”促炎介质的生成,推动疾病进展;同时,EVs还会通过激活toll样受体(TLRs)来调节免疫,比如诱导巨噬细胞向“M2型”极化——这种极化状态对利什曼原虫的存活十分有利。从机制上看,利什曼原虫EVs富含多胺,巨噬细胞高效摄取多胺后,感染率会升高,且M2型标志物“精氨酸酶1”的表达也会增加。另外,含gp63的EVs除了加重疾病,也参与免疫调节。不仅如此,利什曼原虫EVs还能刺激白细胞介素-8(IL-8)、粒细胞集落刺激因子(G-CSF)及血管内皮生长因子-A(VEGF-A),促进血管生成——这在皮肤利什曼病特征性皮肤溃疡的形成中,可能发挥着重要作用。
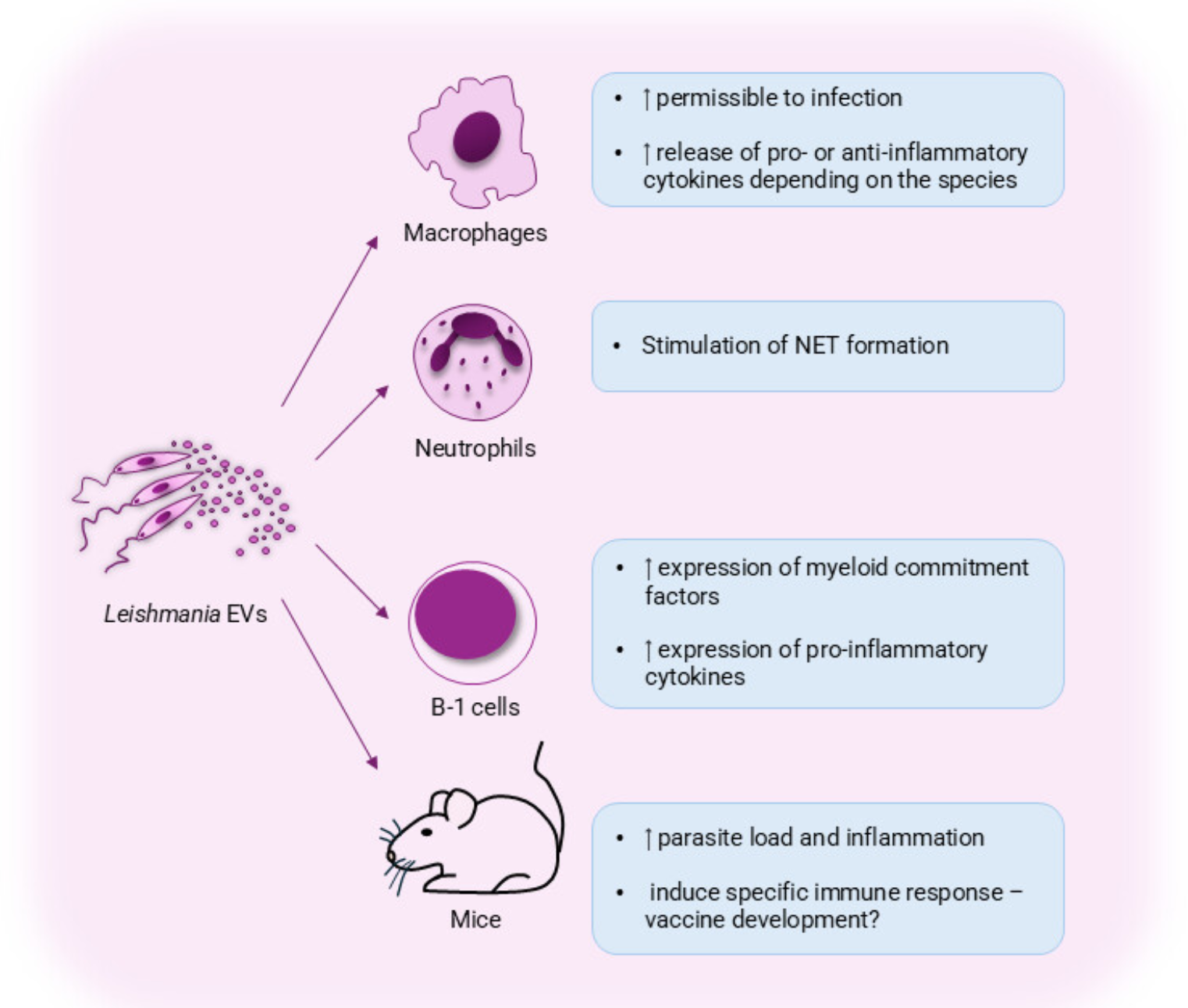
图1 利什曼病中的胞外囊泡:利什曼原虫来源的胞外囊泡对免疫细胞活化及疾病发展的影响
在人源细胞中,也能观察到类似效应:用利什曼原虫EVs预处理人巨噬细胞,会诱导炎性细胞因子生成及炎性小体活化;不过,经EVs刺激的巨噬细胞感染利什曼原虫后,虫荷并没有显著变化,这说明EVs主要调节先天免疫反应,而非直接促进原虫复制。当人中性粒细胞暴露于利什曼原虫EVs后,会通过TLR激活释放中性粒细胞胞外陷阱(NETs),而NETs对前鞭毛体有杀伤作用。这些结果表明,利什曼原虫EVs能激活人类先天免疫,进而可能影响适应性免疫应答。未来,还需研究EVs对其他细胞的作用,比如“原虫在巨噬细胞内稳定定植后,旁体细胞是否更易感染”“是否助力原虫持续存在”“是否进一步加剧皮肤利什曼病的炎症反应”等。
除了巨噬细胞和中性粒细胞,利什曼原虫EVs还能调节B细胞,尤其是具有免疫调节功能的B-1细胞亚型。用亚马逊利什曼原虫EVs刺激B-1细胞,会使其髓系定向因子及肿瘤坏死因子-α(TNF-α)表达增加,提示B-1细胞可能向吞噬细胞样表型转化,增强杀菌能力;而预先接触B-1细胞释放的EVs的小鼠,在实验性感染中预后更好。这揭示了EVs在免疫调节中的“双重性”:虫源EVs可能通过调节宿主免疫促进感染,而宿主来源的EVs或可介导保护性免疫。理解这种平衡,对发现新的免疫调节机制及抗利什曼原虫感染治疗策略至关重要。
在诊断与治疗领域,利什曼原虫EVs也展现出潜力。诊断上,利用利什曼原虫EVs开发的血清学检测方法,对感染者血清的识别灵敏度达95%、特异性达100%;对感染利什曼病的犬血清分析发现,其EVs携带微小RNA(miRNA),提示EVs有望作为疾病生物标志物。治疗上,间充质干细胞(MSCs)来源的EVs可部分控制实验性感染的病灶发展,且不影响虫荷;而MSCs来源的EVs与化疗联合使用时,能产生协同效应。因此,MSCs或B-1细胞来源的EVs,因具有免疫调节特性,有望用于“宿主导向治疗”,尤其适用于炎症反应强烈的利什曼病临床类型。
从感染机制到诊疗潜力,利什曼原虫胞外囊泡就像一串“关键密码”,串联起寄生虫与宿主的相互作用,也为疾病的诊断和治疗开辟了新路径。随着研究的不断深入,这些“微观信使”有望成为利什曼病防控的“突破口”,为全球数百万患者带来康复的希望。(生物谷Bioon.com)
参考文献:
Xander P, de Oliveira CI. mGem: Extracellular vesicles in Leishmania-secret messengers driving infection and disease. mBio. Published online September 22, 2025. doi:10.1128/mbio.03239-24
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


