Nat Cancer:揭示乳腺癌细胞劫持巨噬细胞促进癌症转移机制
来源:生物谷原创 2022-04-26 17:43
癌细胞是如何让肺部血管内皮细胞产生这些促进转移的蛋白呢?
转移性乳腺癌细胞滥用一种称为巨噬细胞的免疫细胞,以促进癌转移灶在肺部定植。这些经过重编程的巨噬细胞刺激血管细胞分泌一系列促进转移的蛋白,这些蛋白是所谓转移微环境(metastatic niche)的一部分。如今,在一项新的研究中,来自德国癌症研究中心和海德堡干细胞技术与实验医学研究所的研究人员在接受人类乳腺癌细胞移植的小鼠身上证实了这一点。这项研究使得他们能够确定新的靶标,并制定初步概念,以更好地抑制乳腺癌的转移性扩散。相关研究结果于2022年4月25日在线发表在Nature Cancer期刊上,论文标题为“Perivascular tenascin C triggers sequential activation of macrophages and endothelial cells to generate a pro-metastatic vascular niche in the lungs”。

癌症在体内扩散时,单个细胞从原发性肿瘤中脱落下来,并通过血液或淋巴系统到达远处的身体区域。在它们能够在继发性部位成长为转移瘤之前,它们必须通过多种分子相互作用与它们所在的新环境进行交流。论文通讯作者、德国癌症研究中心的Thordur Oskarsson说,“为了在这种新的、不友好的环境中定植下来,癌细胞破坏了这种微环境以支持其生长。”科学家们指出这是为肿瘤细胞创造转移微环境。
血管在癌细胞转移中起着非常特殊的作用。脱落下来的肿瘤细胞更愿意呆在其附近。特别是,正如许多研究已经表明的那样,癌细胞与血管内壁的内皮细胞之间的相互作用对癌细胞转移至关重要。然而,这种分子交换的细节在很大程度上仍然是未知的。
这些作者如今研究了乳腺癌细胞在小鼠肺部转移定植期间的这些相互作用。他们首先观察到,肺部血管内皮细胞中的四个基因在转移开始三周后表现出特别强烈的活性增加。它们编码的四种蛋白(Inhbb、Lama1、Scgb3a1和Opg)分泌到转移微环境中,这四种蛋白无论是单独表达还是组合表达都会促进肺部转移灶的产生。Inhbb和Scgb3a1赋予癌细胞干细胞特性,Opg防止细胞凋亡,Lama1支持粘附介导的细胞生存。重要的是,这四种新发现的微环境因子的高表达与乳腺癌患者的无复发生存期缩短和总生存期缩短相关。
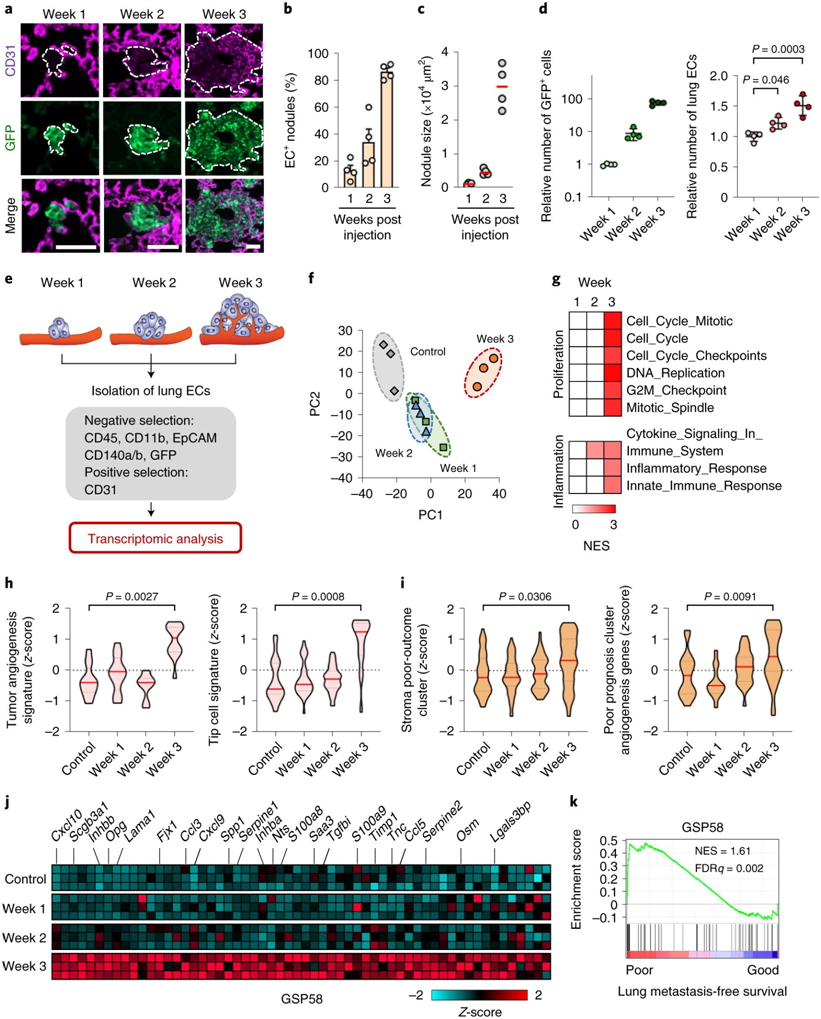
转录组分析发现肺部转移定植期间反应性血管内皮细胞的特征性变化。图片来自Nature Cancer, 2022, doi:10.1038/s43018-022-00353-6。
但是,癌细胞是如何让肺部血管内皮细胞产生这些促进转移的蛋白呢?令这些作者惊讶的是,癌细胞自己并不直接做这项工作,而是利用先天免疫系统中的巨噬细胞来实现这一目的。
论文第一作者Tsunaki Hongu解释说,“这些巨噬细胞通常居住在肺部血管附近,它们被乳腺癌细胞产生的胞外基质蛋白tenascin激活。”蛋白tenascin参与了许多癌症的疾病进展。在被tenascin激活后,巨噬细胞产生多种因子来诱导血管内皮细胞产生这些促癌蛋白。通过使用特定的分子试剂消除巨噬细胞或它们的活动,这些作者可以证实这些细胞对这些促进转移的蛋白的产生至关重要。”
Oskarsson总结说,“癌细胞、巨噬细胞和血管内皮细胞之间交谈的复杂性令人震惊。随着对参与这些转移性相互作用的众多蛋白和其他因子有了更好的了解,我们能够为开发对抗乳腺癌转移的新策略确定多种起点。我们已经为此提出了初步的治疗概念,如今我们需要在进一步的研究中加以验证。”(生物谷 Bioon.com)
参考资料:
1. Tsunaki Hongu et al. Perivascular tenascin C triggers sequential activation of macrophages and endothelial cells to generate a pro-metastatic vascular niche in the lungs. Nature Cancer, 2022, doi:10.1038/s43018-022-00353-6.
2. Reprogrammed macrophages promote spread of breast cancer
https://medicalxpress.com/news/2022-04-reprogrammed-macrophages-breast-cancer.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


