我国学者发布首个通用分子设计世界模型ODesign,实现核酸/蛋白质/小分子等多形态分子的一键式设计
来源:生物世界 2025-11-05 14:38
ODesign在小分子设计基准测试中显著优于系列基准模型,针对复杂的GPCR受体口袋可以一键设计出具备优质结合模式的小分子。
继诺奖团队开发的 AlphaFold3 和 RFDiffusion-AA 横空出世后,通用式生物分子结构预测已达到令人惊叹的精度,为 AI 赋能药物研发领域打下了坚实基础。在药物研发漫长的研发环节中,通用式生物分子设计是下一个 AI 赋能药物研发领域的“圣杯”。
2025 年 10 月 27 日,由临港实验室牵头,联合上海人工智能实验室、香港中文大学、上海交通大学、浙江大学、华盛顿大学、哈佛大学等合作机构,发布了国际首个通用分子设计世界模型——ODesign。
该模型允许科学家在任意类型靶标上指定目标位点,并以精准可控的方式实现蛋白质、多肽、核酸、小分子及金属离子等多类型生物配体的一键式设计。
在多个行业标准测试集上,ODesign 显著优于 RFDiffusion、BindCraft 等主流单形态分子设计模型,标志着生成式 AI 药物研发从“单点突破”迈向“通用智能”的关键跨越。

从“单点突破”到“通用智能”:ODesign 让分子设计进入大统一时代
生命的奇妙,在于“协同”。核酸、蛋白质、小分子和金属离子等生物分子共同构成生命的语言体系,它们彼此作用、相互演化,塑造出复杂的生物秩序。经典药物设计主要聚焦于蛋白靶标,以小分子作为主要干预手段,试图通过“单点突破”实现疾病治愈。然而,这一模式正面临系统性瓶颈,约 85–90% 的人类蛋白仍被视为“不可成药”靶点,缺乏可被小分子精准调控的结合位点。同时,RNA、DNA 等非蛋白靶标在疾病调控中愈发重要,其复杂性却使传统药物发现难以有效介入,限制了我们对疾病机制的系统理解。
由于生物分子结构和功能上的多样性,当前主流AI分子设计方法仍多停留在“单模态突破”的阶段,如单一的蛋白质或者小分子设计。这些模型在各自领域中表现出色,但不同模态之间依然存在难以跨越的表征鸿沟:蛋白质模型难以理解小分子的化学特征,而小分子模型又无法捕捉蛋白体系的结构语义。这种“模态孤岛”现象,使人工智能在复杂生命体系的整体建模与协同设计中仍受制约。
ODesign 的出现打破了这一壁垒。它像是一位能同时理解蛋白、核酸、小分子和金属离子等生命分子的“通用分子生物学家”,既理解它们在形状、能量和电荷分布上的规律,也能掌握它们相互作用的底层法则,从而实现逆向设计。ODesign 作为一种通用的世界模型,能在原子层面上像搭积木一样精准构筑新的相互作用模式。由此,研究者可以像编程一样指定靶标分子的表位或口袋,在统一范式下完成不同形态分子的一键式可控设计。

基于 ODesign 的多形态分子设计案例,允许用户在任意类型靶标上指定目标位点,并以精准可控的方式实现蛋白质、多肽、核酸、小分子及金属离子等多类型生物配体的一键式设计。
更重要的是,ODesign 在速度和规模上也实现了质的飞跃:在相同硬件条件下,其设计效率较同类模型提升近 50 倍,将完整的计算设计周期从过去的数天压缩至短短数小时。对于药物研发而言,这不仅意味着生产力的重塑,更标志着一个 AI 分子设计的“通用智能时代”的开启。
从理解到创造:ODesign 构筑生物分子的万相世界
AlphaFold3 的问世已经证明 AI 在“预测”生物大分子结构的任务上可以达到接近实验精度的水平。
而 ODesign 的核心创新,则是更进一步地以“指定任意靶标,生成任意结合配体”为核心目标,在生物大分子领域让 AI 从“预测”迈向了真正的“创造”。
ODesign 的研发团队意识到,一个高性能的结构预测模型往往蕴含丰富的原子间相互作用知识,而这种知识对“创造”也至关重要。基于这一认识,研究团队以 AlphaFold3 为参考,训练了一套全模态分子设计的基座模型。ODesign 采用了全新的结构生成架构,由五个核心模块协同驱动:
1、不同分子模态的多层级表征:面向蛋白质、DNA、RNA、小分子和离子采用了不同层级的表征方式,并设定不同分子模态基本单元的抽象表征以进行设计。
2、多尺度灵活可控的条件模块:在条件模块中通过掩码机制的方式实现原子级、残基级和分子级的条件约束,从而实现不同的分子设计功能。
3、建模分子间相互作用模块:通过 pairformer 模块建模不同分子间的相互作用,并利用模板信息实现靶点蛋白的结构柔性约束。
4、三维重建的条件解码器:通过扩散模型实现原子级结构生成并利用结构条件实现刚性约束。
5、分子序列生成模块:OInvFold 模块基于生成的骨架 token 推断对应模态的最小单元类型,从而针对不同分子模态实现特异性的序列生成。
通过跨模态共享的生成语言,ODesign 将蛋白的氨基酸、RNA 和 DNA 的碱基、小分子原子以及金属离子统一映射到一个通用的分子生成空间中。在这个空间里,AI 不再区分分子形态,而是基于原子间相互作用和化学键约束进行“协同构建”。这种从概念到物理世界的统一,让模型在三维空间中能以原子精度生成符合真实化学规律的分子结构。
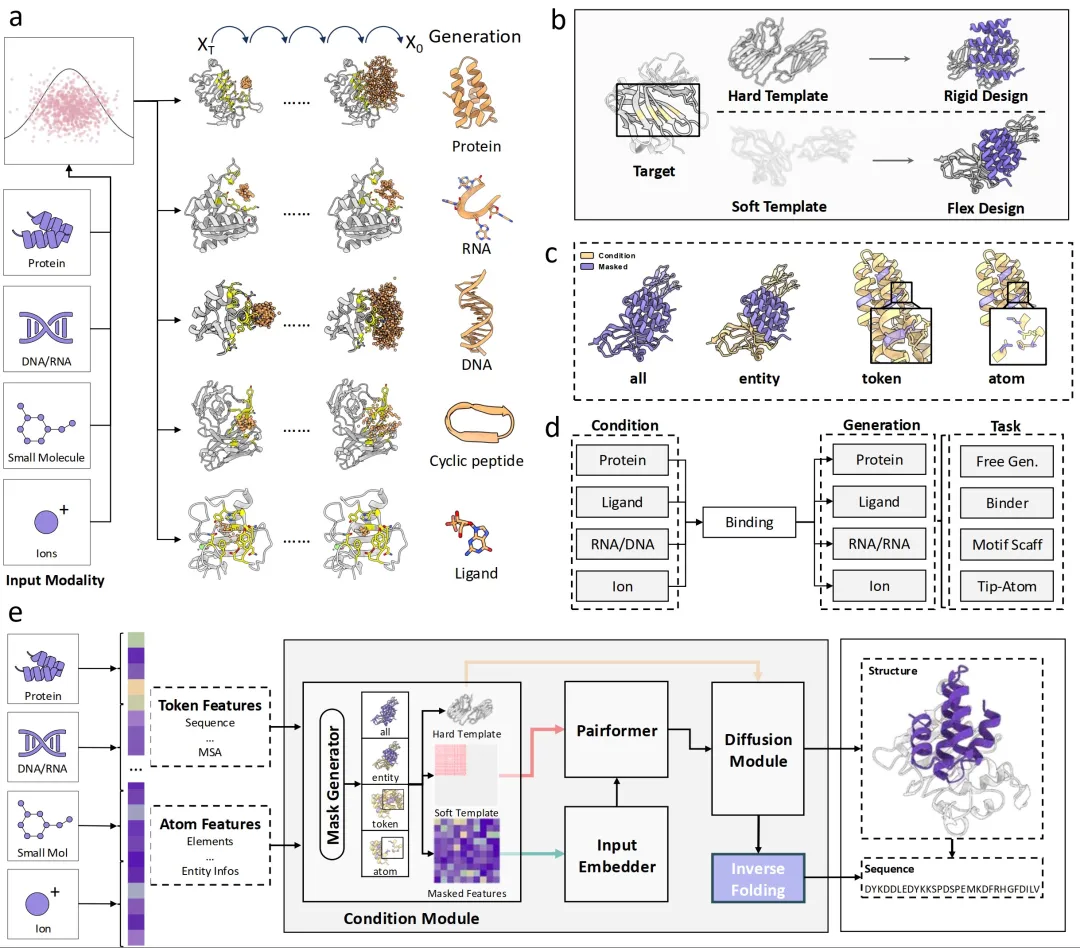 ODesign通用分子设计框架概览,通过统一掩码机制与扩散生成架构,ODesign在刚性与柔性构象下均可精准控制分子交互,实现可编程的生物设计。
ODesign通用分子设计框架概览,通过统一掩码机制与扩散生成架构,ODesign在刚性与柔性构象下均可精准控制分子交互,实现可编程的生物设计。
性能验证:在 11 项分子设计任务中全面领先
为了证明 ODesign 的通用性与可行性,研究团队在蛋白、核酸和小分子三大模态的 11 项分子设计任务上进行了系统测试。这些任务覆盖了从蛋白质、RNA 和 DNA 单体结构到多种分子模态结合体的设计领域。
蛋白质因其序列的可编程性和合成可行性,是当前分子设计领域最成熟的模态。ODesign 在现有基础上进一步扩展了蛋白设计的能力边界,在蛋白质结合体、基序骨架生成、复合物界面重构和酶功能优化方面取得了生成精度和结构可控性等关键指标的显著优势。这全面反映 ODesign 模型的多层级设计能力和结构生成的泛化性能。

ODesign在蛋白设计任务中展现速度与精度的双重优势。a) ODesign与BindCraft、RFDiffusion及BoltzDesign以单块GPU每日成功设计数量为指标进行比较,ODesign具有显著优势;b) MotifBench基准测试上,ODesign取得相比于RFDiffusion和RFDiffusion-AA更高的蛋白设计成功率。C) 在AME数据集上,ODesign在基于骨架的设计上比 RFDiffusion-AA 和 RFDiffusion2 有显著优势。
核酸作为另一类具有序列可编程性的生物分子,在分子识别、基因调控与药物开发中发挥着关键作用。然而由于结构数据相对稀疏,现有设计方法局限单一模态,且滞后于蛋白设计领域。ODesign 融合多模态分子数据,实现 DNA 和 RNA 的统一生成体系,并在 60nt 的 RNA 和 DNA 单体设计任务中实现约 60% 和 20% 的 RMSD 成功率,且生成的复合物具有合理的分子相互作用界面。
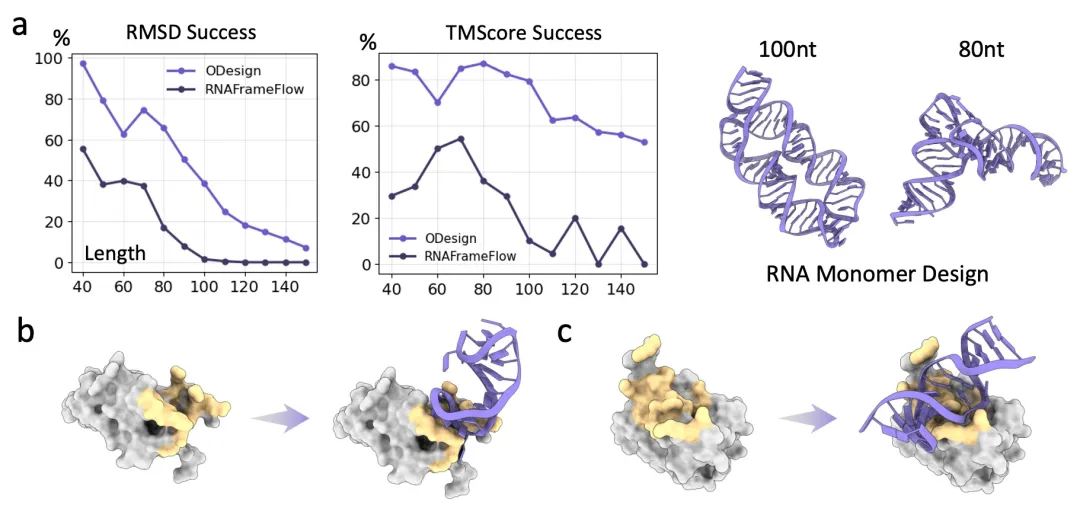
ODesign 在核酸设计基准测试中显著优于基准模型RNAFrameFlow,可以设计出高质量的DNA和RNA适配体。
小分子设计是结构最复杂、应用最广泛的分子模态,其环系、支链和手性等复杂的拓扑结构,对模型的化学理解和空间推理能力提出更高的要求。ODesgin 在 6 个蛋白靶标上相对主流 RFDiffusion-AA 提升约 4 倍的成功率;在靶向 RNA 的小分子设计任务中实现高置信度的分子生成;并且成功在 DNA 结合体设计任务上生成结合界面合理且能量稳定的候选分子。

ODesign在小分子设计基准测试中显著优于系列基准模型,针对复杂的GPCR受体口袋可以一键设计出具备优质结合模式的小分子。
从科研工具到创制平台:开启 AI 驱动的分子创制新纪元
ODesign 研发团队已经推出了在线试用系统,向科研机构和产业用户开放,支持各形态分子生成、结构可视化与分析等核心功能,帮助研究人员以序列或结构输入的方式快速获得高质量分子候选。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


