Nature子刊:上海科技大学水雯箐/庄敏团队解析内源GLP-1受体的细胞膜蛋白互作组
来源:生物世界 2024-09-05 09:22
该研究不仅为内源GLP-1R的细胞膜蛋白互作组解析提供了一种新型的化学生物学技术,也为深入理解其细胞类型特异的功能调控机制奠定了基础。
上海科技大学iHuman研究所、生命科学与技术学院水雯箐课题组联合庄敏课题组,在 Nature Chemical Biology 期刊发表了题为:Endogenous cell membrane interactome mapping for the GLP-1 receptor in different cell types 的研究论文。
该研究发展了基于配体的邻近标记技术,实现对内源表达的GLP-1R的互作蛋白质组的特异标记、组学鉴定与动态调控分析。
研究团队首先设计了GLP-1配体与邻近标记酶偶联的两种探针,预测该探针在结合并激活受体后能够标记与受体发生互作的邻近细胞膜蛋白(图1)。在过表达受体的293T细胞以及内源表达受体的两种细胞(INS-1E胰岛β细胞和SK-N-SH类神经细胞)中,研究者通过一系列验证实验,证明了偶联抗坏血酸过氧化物酶(APEX2)的探针具有与天然GLP-1相当的结合受体、激活下游信号及诱导内吞的活性,且能实现高特异性的细胞表面标记。

图1:基于配体的邻近标记的实验设计
然后,研究团队将邻近标记与定量蛋白质组学技术结合,在INS-1E胰岛β细胞与SK-N-SH类神经细胞中分别解析了内源GLP-1R的细胞膜蛋白互作组。有趣的是,从这两种细胞得到的互作组在分子组成上完全独立,并且与数据库中记录的过表达GLP-1R的潜在互作蛋白的重合度也很低,这反映出内源性受体在不同细胞类型中的互作蛋白质组的独特性。
对于两种细胞中新发现的若干GLP-1R潜在互作蛋白,研究团队首先利用生化实验验证了11个候选蛋白与GLP-1R的相互作用。其次,在INS-1E β细胞中,证明5个互作蛋白的敲低会显著提高高糖条件下GLP-1刺激的胰岛素释放效应。进一步的机制研究暗示,这些细胞膜互作蛋白主要通过抑制GLP-1R介导的cAMP信号通路来削弱GLP-1刺激的胰岛素释放。
综合功能实验结果,该研究最终发现了3个之前未知的位于细胞膜上的GLP-1R调控因子——SLC4A4、ATP1B3和GPC4。最后,研究团队在INS-1E β细胞中完成了时间分辨的邻近标记组学实验,在多时间点上追踪受体激活与内吞过程中的膜蛋白互作组变化,构建了内源GLP-1R的动态细胞膜蛋白互作组图谱(图2)。
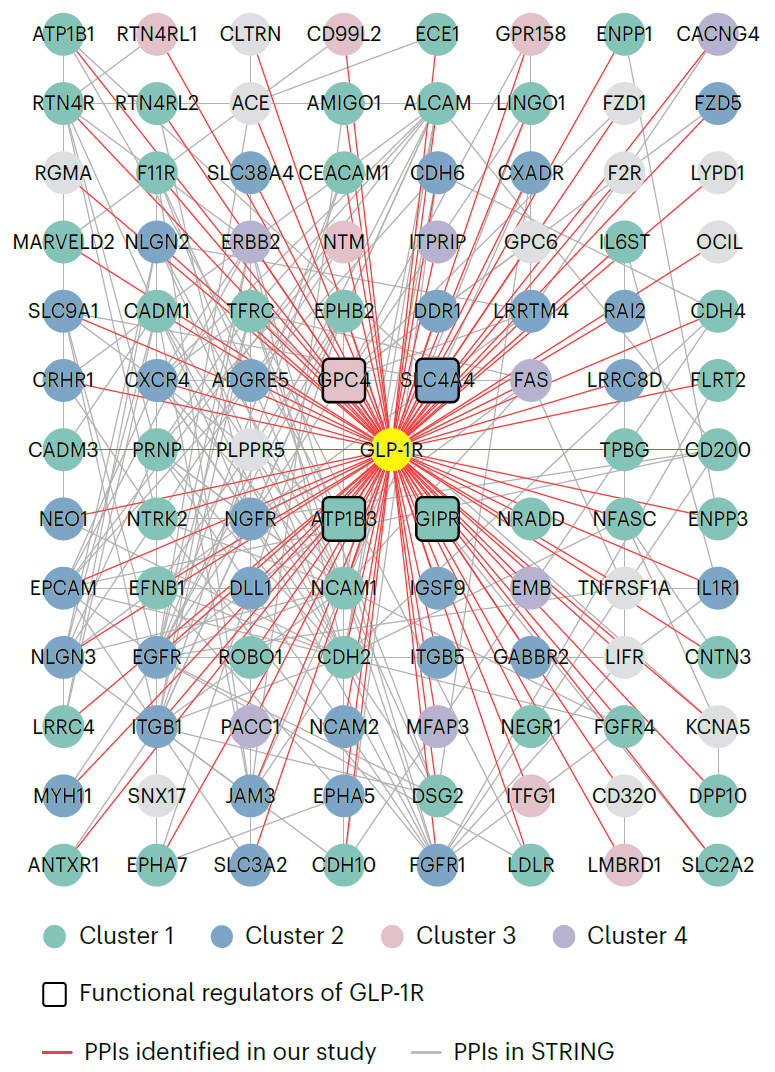
图2:INS-1E细胞中内源GLP-1R的细胞膜蛋白互作组图谱
综上所述,该研究不仅为内源GLP-1R的细胞膜蛋白互作组解析提供了一种新型的化学生物学技术,也为深入理解其细胞类型特异的功能调控机制奠定了基础。GLP-1R属于G蛋白偶联受体家族,这种基于配体的邻近标记策略有望推广至该家族中其他重要的药物靶标,为研究组织特异性的药物作用机制提供新的理论依据。
上海科技大学生命科学与技术学院2021级博士研究生党婷、2023级博士研究生余洁、2020级博士研究生曹致和为论文共同第一作者。iHuman研究所研究员、生命学院常任副教授水雯箐与生命学院常任副教授庄敏为共同通讯作者,上海科技大学为第一完成单位。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


