偏头痛急性治疗新药!新型口服多机制药物AXS-07计划重新提交上市申请:快速有效持久缓解偏头痛!
来源:生物谷原创 2022-09-30 03:44
AXS-07具有独特的双重作用机制,开发用于偏头痛急性治疗。

图片来源:摄图网
2022年09月30日讯 /生物谷BIOON/ --Axsome Therapeutics是一家致力于开发创新疗法治疗中枢神经系统(CNS)疾病的生物制药公司。近日,该公司宣布,在与美国食品和药物管理局(FDA)成功举行了A类会议后,打算在2023年第三季度重新提交新型口服多机制药物AXS-07(MoSEIC meloxicam/rizatriptan,20mg/10mg)用于偏头痛急性治疗的新药申请(NDA)。
Axsome于2021年9月首次提交NDA,但在2022年5月收到了来自FDA拒绝批准AXS-07的完整回复函(CRL)。临床数据显示,AXS-07治疗可迅速、有效、持久地缓解偏头痛及相关症状,且具有良好的安全性和耐受性。
A类会议的目的是获得FDA对公司计划的反馈和同意,以解决之前收到的完整回复函(CRL)中提出的问题,以支持AXS-07 NDA的重新提交。这些问题主要与化学、制造和控制(CMC)考虑因素有关。根据FDA的反馈,该公司将在其重新提交的文件包中包括新的CMC信息,包括新生产的商业规模AXS-07批次的稳定性数据。重新提交的文件包还可能包括其他临床药理学信息。公司预计,NDA重新提交的文件将被指定为2类文件,需要经过六个月的审查。FDA没有要求进行额外的临床疗效或安全性试验,以重新提交NDA。
AXS-07(MoSEIC meloxicam/rizatriptan,20mg/10mg)是一种新型口服药物,具有独特的双重作用机制,目前正在临床开发,用于偏头痛的急性治疗。AXS-07由MoSEIC美洛昔康(meloxicam)和利扎曲普坦(rizatriptan)组成。美洛昔康是采用Axsome公司MoSEIC(分子溶解度增强包合物)技术实现治疗偏头痛的一种新分子实体,该技术可使美洛昔康快速吸收同时维持较长的血浆半衰期。美洛昔康是一种COX-2偏向性非甾体抗炎药,利扎曲普坦是5-HT1B/1D激动剂。AXS-07旨在提供快速、增强和持续的偏头痛缓解,减少症状复发。
AXS-07用于偏头痛急性治疗的疗效和安全性,在2项3期随机、双盲、对照试验(MOMENTUM,INTERCEPT)中得到了证实。MOMENTUM研究中入组的是有治疗应答不足病史的患者,并且一旦出现中度或重度偏头痛发作时就给予治疗;INTERCEPT研究与之不同的是,在偏头痛最早期症状出现时即给予AXS-07治疗。这2项试验证实,与安慰剂和阳性对照药物相比,AXS-07治疗在统计学上显著消除了偏头痛疼痛和最烦人症状。
MOMENTUM研究结果详见:MOMENTUM Phase 3 Trial Topline Results。INTERCEPT研究结果详见:INTERCEPT Phase 3 Trial Topline Results。
Axsome首席执行官Herriot Tabuteau医学博士表示:“我们对A类会议的结果非常满意,该会议澄清了我们重新提交AXS-07偏头痛急性治疗NDA的方法。我们感谢FDA深思熟虑的参与,并期待着成功的再次提交NDA。世界卫生组织(WHO)已将严重偏头痛发作导致的残疾,列为与四肢瘫痪、痴呆、急性精神病程度的相同。如果获得批准,AXS-07将为数百万患有这种虚弱疾病的人群提供重要的新治疗选择。”
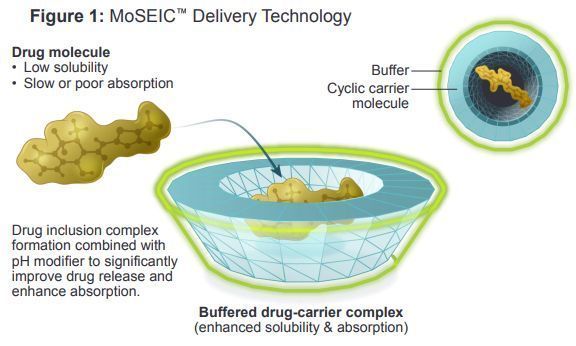
MoSEIC技术
MOMENTUM是一项随机、双盲、安慰剂对照和阳性药物对照III期试验,根据FDA特别方案评估(SPA)开展,旨在评估AXS-07在中度至重度偏头痛急性治疗中的有效性和安全性。该研究采用偏头痛治疗优化问卷[mTOQ-4]进行评估,仅入组对先前急性偏头痛治疗有应答不足病史的患者。研究中,共有1594例患者以2:2:2:1的比例随机分配,接受AXS-07(20mg MoSEIC美洛昔康/10mg利扎曲普坦)、利扎曲普坦(10mg)、MoSEIC美洛昔康(20mg)、安慰剂治疗。研究的2个共同主要终点是AXS-07在给药后2小时头痛疼痛消除的患者比例,以及在给药后2小时最烦人偏头痛相关症状(恶心、畏光或畏声)消除的患者比例。利扎曲普坦是该研究中的一种阳性对照药物,被认为是目前治疗偏头痛最有效的药物之一。
结果显示,研究达到了2个共同主要终点,数据具有高度统计学意义:在给药后2小时,AXS-07治疗组与安慰剂组相比,有更高比例的患者实现疼痛消除(19.9% vs 6.7%,p<0.001)和无最烦人症状(36.9% vs 24.4%,p=0.002)。此外,AXS-07还达到了SPA中指定的相对于利扎曲普坦、MoSEIC美洛昔康、安慰剂的优越性:在给药后2-24小时,有更高比例的患者实现持续疼痛消除(比例分别为:16.1%、11.2%、8.8%、5.3%;p=0.038、p=0.001、p<0.001)。共同主要终点和组分贡献证明的阳性结果支持AXS-07用于偏头痛急性治疗新药申请(NDA)的监管提交。
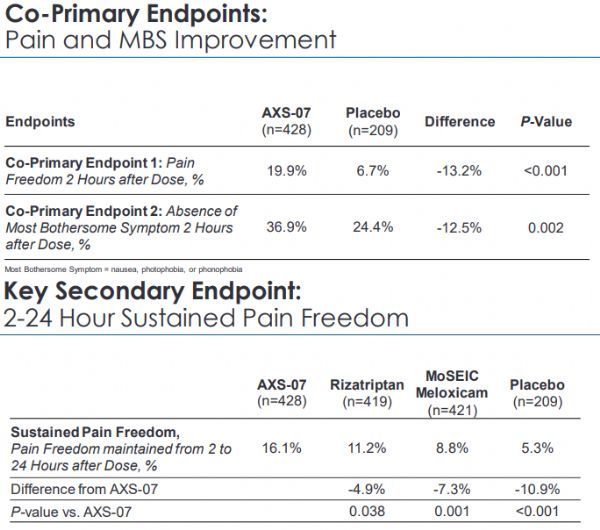
MOMENTUM研究主要终点&关键次要终点结果
此外,与安慰剂和利扎曲普坦相比,AXS-07提供了更大程度和更持久的偏头痛缓解,偏头痛抢救药物使用显著减少。给药后2-24小时疼痛持续缓解的患者比例,AXS-07组为53.3%、安慰剂组为33.5%、利扎曲普坦组为43.9%(与AXS-07相比,分别为p<0.001、p=0.006)。在2-48小时内持续疼痛缓解的患者比例也显著更高,AXS-07组为46.5%、安慰剂组为31.1%、利扎曲普坦组为36.5%(与AXS-07组相比,分别为p<0.001、p=0.003)。使用了抢救性药物的患者比例,AXS-07组为23.0%、安慰剂组为43.5%、利扎曲普坦组为34.7%(与AXS-07相比,均p<0.001)。
AXS-07能迅速缓解偏头痛,在15分钟开始测量的每个时间点,AXS-07达到缓解偏头痛的患者比例在数值上大于利扎曲普坦组,在60分钟时统计学上显著高于利扎曲普坦组(p=0.04)。给药后1.5小时疼痛缓解的患者比例AXS-07为60.5%,而利扎曲普坦为52.5%,安慰剂为48.3%(与AXS-07相比,分别为p=0.019、p=0.004)。AXS-07在其他几个次要终点(包括患者对变化的整体印象[PGI-C],p=0.022)、在24小时恢复正常功能(p=0.027)方面显著优于利扎曲普坦。
该研究中,AXS-07安全且耐受性良好。AXS-07最常见的不良反应是恶心、头晕和嗜睡,这些不良反应的发生率均不高于安慰剂或3%。AXS-07治疗组发生一例严重不良事件,被研究调查员认为与研究药物无关。

INTERCEPT研究结果
INTERCEPT是一项随机、双盲、单剂量、安慰剂对照III期研究,正在评估AXS-07与安慰剂用于偏头痛早期治疗的疗效和安全性。该研究中,302例成人患者以1:1的比例随机分配,在出现偏头痛最早期症状、疼痛强度尚处于轻微时,立即给予单剂量AXS-07或安慰剂治疗。研究的2个共同主要终点是给药后2小时无头痛(头痛消除)的患者比例,以及给药后2小时不再出现最烦人偏头痛相关症状(恶心、畏光、畏声)的患者比例。
结果显示,该研究达到了2个共同主要终点:AXS-07治疗组在给药后2小时疼痛消除(32.6% vs 16.3%,p=0.002)和最烦人症状消除(43.9% vs 26.7%,p=0.003)的患者比例在统计学上显著高于安慰剂组。此外,与安慰剂组相比,AXS-07治疗组在给药后2-24小时(22.7% vs 12.6%,p=0.030)和给药后2-48小时(20.5% vs 9.6%,p=0.013)取得持续疼痛消除的患者比例显著高于安慰剂组。研究中,AXS-07单剂量给药后迅速消除了偏头痛症状,在偏头痛疼痛消除和最烦人症状消除方面,给药后最早30分钟开始与安慰剂出现数值分离,在90分钟(p=0.003)和此后的每个时间点达到统计学显著差异。
此外,单剂量AXS-07显著地阻止了偏头痛进展至超过轻度轻度、同时显著减少了急救药物(rescue medication)的使用。AXS-07治疗组有73.5%的患者、安慰剂组有47.4%的患者在给药后2-24小时内没有疼痛进展(p<0.001)。对疼痛进展的积极影响转化为对急救药物使用的显著减少,AXS-07治疗组只有15.3%的患者在给药后24小时内需要急救药物,而安慰剂组为42.2%(p<0.001)。
AXS-07还显著降低了功能性残疾,并显示出整体疾病的改善。AXS-07治疗组有73.5%的患者能够在24小时内进行正常活动,而安慰剂组为47.4%(p<0.001)。在患者总体印象变化量表(PGI-C)方面,AXS-07治疗组有52.4%的患者、安慰剂组有27.7%的患者有极大改善(very much improved)或很大改善(much improved)。
研究中,AXS-07总体上是安全和耐受性良好的。AXS-07最常见的不良反应是嗜睡、头晕和感觉异常,所有这些不良反应的发生率都低于5%。试验中无严重不良反应。(生物谷Bioon.com)
原文出处:axsome therapeutics announces plans to resubmit axs-07 nda based on successful fda type a meeting
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


