Science:利用低温电镜揭示光系统II中的氢位置和水网络
来源:生物谷原创 2024-06-27 15:27
这项研究中用于确定质子和氢原子位置的创新方法对于理解光合系统 II 至关重要,具有广泛的应用前景。
在一项新的研究中,来自德国柏林洪堡大学、波茨坦大学、瑞典于默奥大学和乌普萨拉大学的研究人员利用低温电镜,成功地以前所未有的纳米级分辨率可视化观察到光合作用过程中的原子结构。他们特别研究了一种称为光系统 II(photosystem II)的蛋白结构,光合作用的第一步就是在光系统 II 中进行的:光被吸收并用作能量源,驱动水分子分裂成氧、质子和电子。相关研究结果发表在2024年6月21日的Science期刊上,论文标题为“Cryo–electron microscopy reveals hydrogen positions and water networks in photosystem II”。

了解光合作用的决定性一步
这种高分辨率可视化技术为人们提供了有关光系统 II 中氢相互作用的新见解,其中这些相互作用对于光能驱动的反应至关重要。因此,在柏林洪堡大学生物系的 Rana Hussein 博士和 Athina Zouni 教授、于默奥大学的 Wolfgang Schröder 教授和乌普萨拉大学的 Johannes Messinger 教授的领导下,这些作者在了解复杂的光合作用过程方面迈出了重要的一步。
Zouni说,“通过使用低温电镜,我们如今可以观察到光系统 II 中氢的位置。这种细致的观察对于了解氧气进化生物将光能转化为化学能的过程至关重要---这一过程是地球上生命的基础。”
柏林洪堡大学的Holger Dobbek 教授详细解释说,“我们使用低温电镜以更高的分辨率显示光系统 II。这使我们能够检测到光系统 II的反应中心位点中的几个氨基酸残基中的氢,从而提供了有关光系统 II 中电子和质子传递的新信息。我们的研究揭示了一系列导致移动质体醌B(plastoquinone B)第二次质子化的事件,这深刻地更新了我们对光合作用中电子传递链的理解。”
研究方法远远超出了光合作用领域
Hussein说,“这项研究中用于确定质子和氢原子位置的创新方法对于理解光合系统 II 至关重要,具有广泛的应用前景。它可用于研究多种蛋白,以便揭示与氢相关的机制。这将在生物和化学研究的多个领域实现突破。因此,这项研究中使用的低温电镜方法具有超越光合作用的意义。”
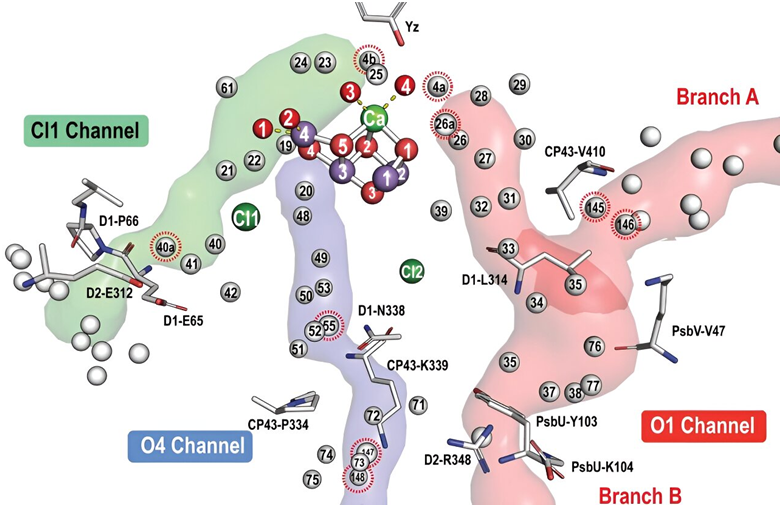
图片来自Science, 2024, doi:10.1126/science.adn6541
在低温电镜中,蛋白复合物会在几分之一秒内冷却到极低的温度,最低可达-260°C。这种极速冷冻可以防止冰晶的形成,从而使分子保持其自然形态。
在未来,对氢的可视化观察可能有助于理解其他基本的生化反应,如酶的机制、蛋白-配体相互作用或膜蛋白的动力学。(生物谷Bioon.com)
参考资料:
Rana Hussein et al. Cryo–electron microscopy reveals hydrogen positions and water networks in photosystem II. Science, 2024, doi:10.1126/science.adn6541.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


