《免疫》:浙大二院团队首次发现,静息态小胶质细胞能够直接影响神经元的电兴奋性!
来源:奇点糕 2022-10-05 10:21
高血压作为心血管疾病的主要危险因素,容易诱发心梗、中风等心血管疾病和神经退行性疾病,在>60岁人群中发病率高达2/3。
高血压作为心血管疾病的主要危险因素,容易诱发心梗、中风等心血管疾病和神经退行性疾病,在>60岁人群中发病率高达2/3。
目前临床治疗中,降压药主要是通过舒张外周血管阻力或减少水钠潴留而达到降压效果。然而,顽固性高血压即便联合使用多种药物,仍不能得到有效缓解;部分高血压发病机制尚不明确,临床中尚无有效的防治方法。
尽管高血压的病因各不相同,但大多数原发性高血压患者存在交感神经活动升高,而肾交感消融术(RSD)可以有效缓解高血压症状[1]。因此,交感神经的中枢稳态对于心血管至关重要,但其机制尚不清楚。
近期,浙江大学医学院附属第二医院史鹏与基础医学院沈啸和谷岩研究团队合作,在《免疫》杂志上发表研究成果[2]。
他们首次发现,静息态小胶质细胞通过分泌血小板源性生长因子(PDGF)B直接作用下丘脑室旁核(PVN)前交感神经元受体PDGFRα,促进神经元Kv4.3钾离子通道蛋白表达,防止神经元超兴奋,维持交感神经张力和血压正常。如果PDGFBMG-Kv4.3Neuron通路被破坏,会诱发血压升高。

论文首页截图
小胶质细胞作为大脑中的固有免疫细胞,其发育、成熟和衰老与中枢神经系统同步[3]。
已有研究表明,小胶质细胞通过其分支实时监测中枢神经系统局部微环境[4],不仅参与免疫调控,而且在神经发育、神经元兴奋性与神经环路等方面均有重要调节作用[5]。
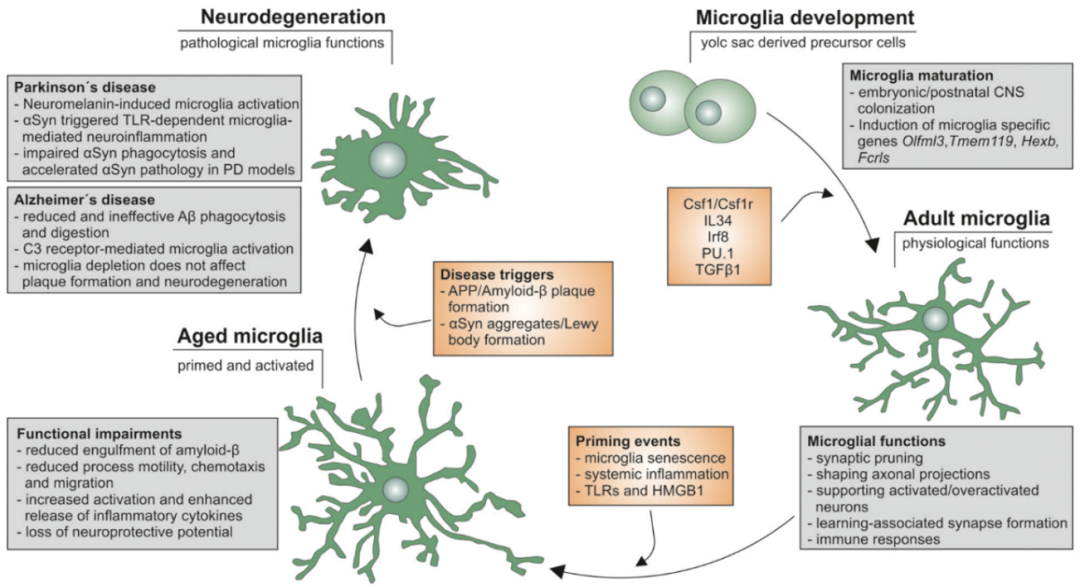
小胶质细胞生命周期示意图[3]
小胶质细胞对于神经元直接调控作用主要通过“突触修剪”[6-7],直到2020年《自然》杂志上有研究揭示,在纹状体中,小胶质细胞能够感知神经元激活并通过ATP-AMP-ADO-A1R信号通路抑制神经元兴奋性,起到“刹车缓冲”作用[8]。然而,对于小胶质细胞直接调控神经元电生理特性尚无直接证据。
在心血管系统中,交感神经末梢贴着血管壁生长,其兴奋会引起血管收缩,改善交感神经张力是缓解高血压的有效手段,例如,临床中RSD可以有效缓解顽固性高血压。然而,小胶质细胞能否通过维持神经元正常兴奋性,而介导中枢交感神经稳态进而调控血压尚无报道。
受此启发,研究人员想从交感神经的角度去解析高血压的发病机制。顺藤摸瓜,他们联合单细胞测序、蛋白质组学和表观遗传学等技术,试图从分子层面揭示小胶质细胞对高血压的调控机制。
首先,研究者在CD11b-DTR转基因小鼠侧脑室注射白喉毒素(DT),去除静息态小胶质细胞,结果导致小鼠交感神经兴奋,表现为小鼠外周血清去甲肾上腺素(NE)和肾上腺素升高,基础心率增加。
随后,他们采用膜片钳对下丘脑室旁核(PVN)中投射到脑干头端腹侧延髓(RVLM)的前交感神经元(即PVN-RVLM)进行电生理分析,发现去除小胶质细胞可以导致交感神经元过度活化,表现为放电神经元比例和放电频率增加、外向钾电流被抑制。
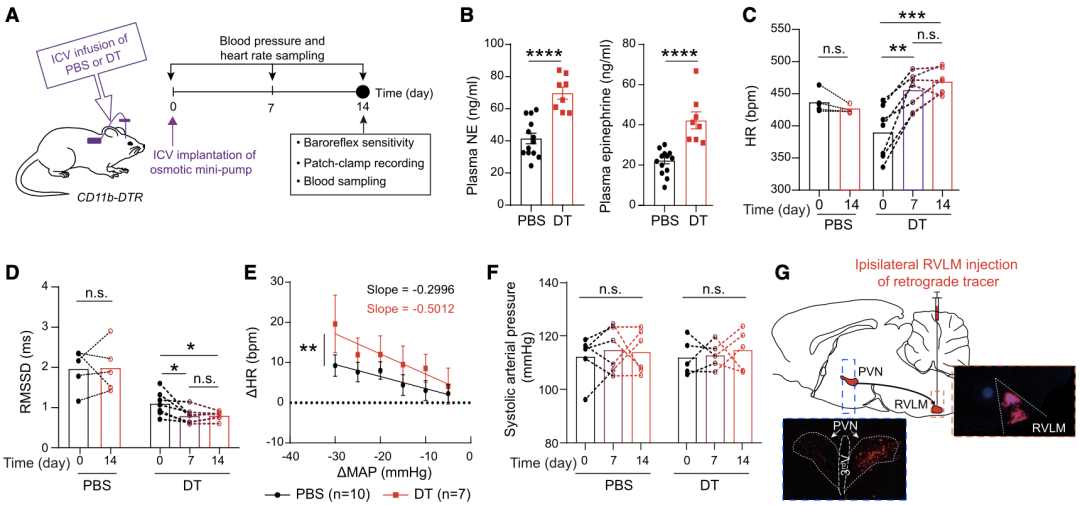
去除小胶质细胞缺失导致交感神经兴奋和PVN前交感神经元过度活化
钾离子通道是调控神经元兴奋性的关键因素,为了探究上述机制,团队采用单细胞测序技术开展了更深入的研究。
他们发现去除小胶质细胞后,PVN-RVLM神经元编码Kv4.3钾离子通道的Kcnd3基因表达明显下调;离体共培养小胶质细胞系BV2,可以显著增加神经元样嗜铬细胞瘤PC12细胞中Kv4.3表达。
此外,如果选择性抑制Kv4.3,可明显阻断低压激活的钾离子电流,这表明静息小胶质细胞可通过增加神经元上的Kv4.3维持神经元正常兴奋性。
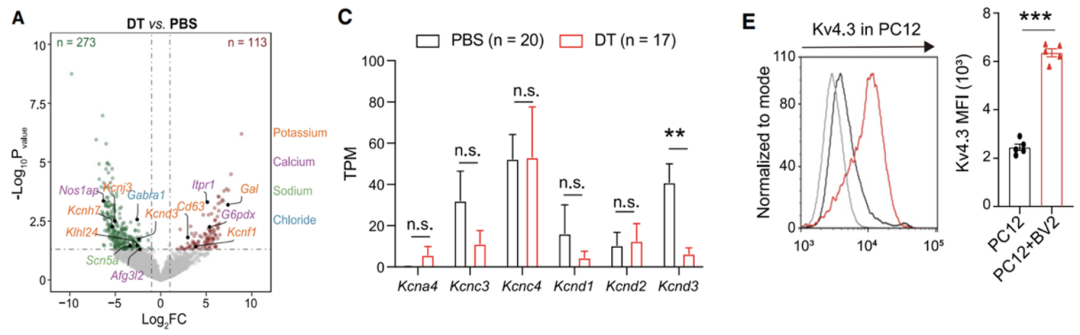
去除小胶质细胞减少PVN前交感神经元Kv4.3的表达
接下来,研究团队尝试采用转录组学方法,鉴定小胶质细胞调控神经元Kv4.3表达的潜在机制。
已有研究表明,PDGF可参与调控少突胶质细胞的钾离子通道,而Pdgfb(编码PDGFB的基因)在小胶质细胞中高表达,当去除小胶质细胞后,Pdgfb表达显著降低。
此外,特异性去除小胶质细胞上的Pdgfb或给与PDGFR抑制剂,可降低PVN-RVLM神经元上Kv4.3的表达;同时,前者能够诱导出PVN交感前神经元K+电流减弱和交感神经兴奋。
以上研究结果表明,小胶质细胞通过旁分泌PDGFB调控神经元Kv4.3。
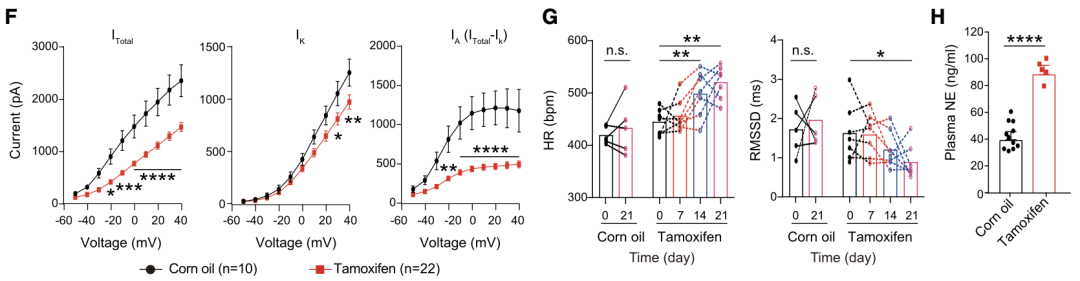
去除小胶质细胞来源的PDGFB导致PVN交感前神经元K+电流减弱和交感神经兴奋
已有研究表明,PDGFB可与两种受体PDGFRα和PDGFRβ结合。离体细胞实验发现,只有使用PDGFRα拮抗剂可以降低小胶质细胞Kv4.3表达,当特异性敲除神经元PDGFRα后,能够引起小鼠血压升高和钾离子电流降低,模拟去除小胶质细胞的效应。
有意思的是,PDGFR属于酪氨酸激酶家族成员,其抑制剂(TKI)被临床广泛应用于抗肿瘤治疗,但该药会导致高血压这一不良反应,本研究在一定程度上为此现象提供了明确的分子机制。
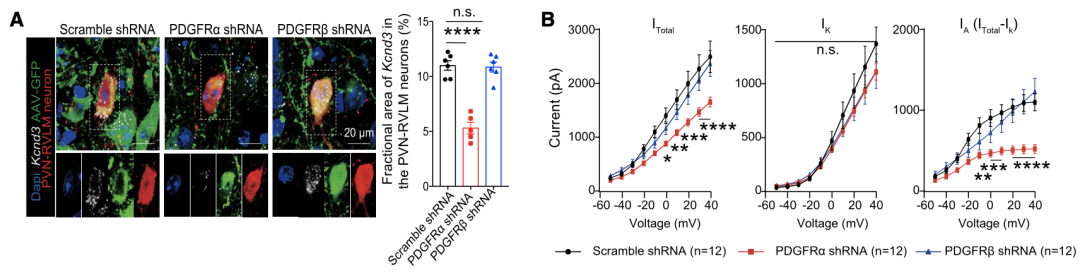
神经元PDGFRα是小胶质细胞调控交感神经的下游靶点,
敲除PDGFRα导致PVN交感前神经元K+电流减弱
最后,通过侧脑室注射外源性PDGFB或增加神经元Kv4.3表达,均能够明显逆转去除小胶质细胞引起血压升高和钾离子电流被抑制。
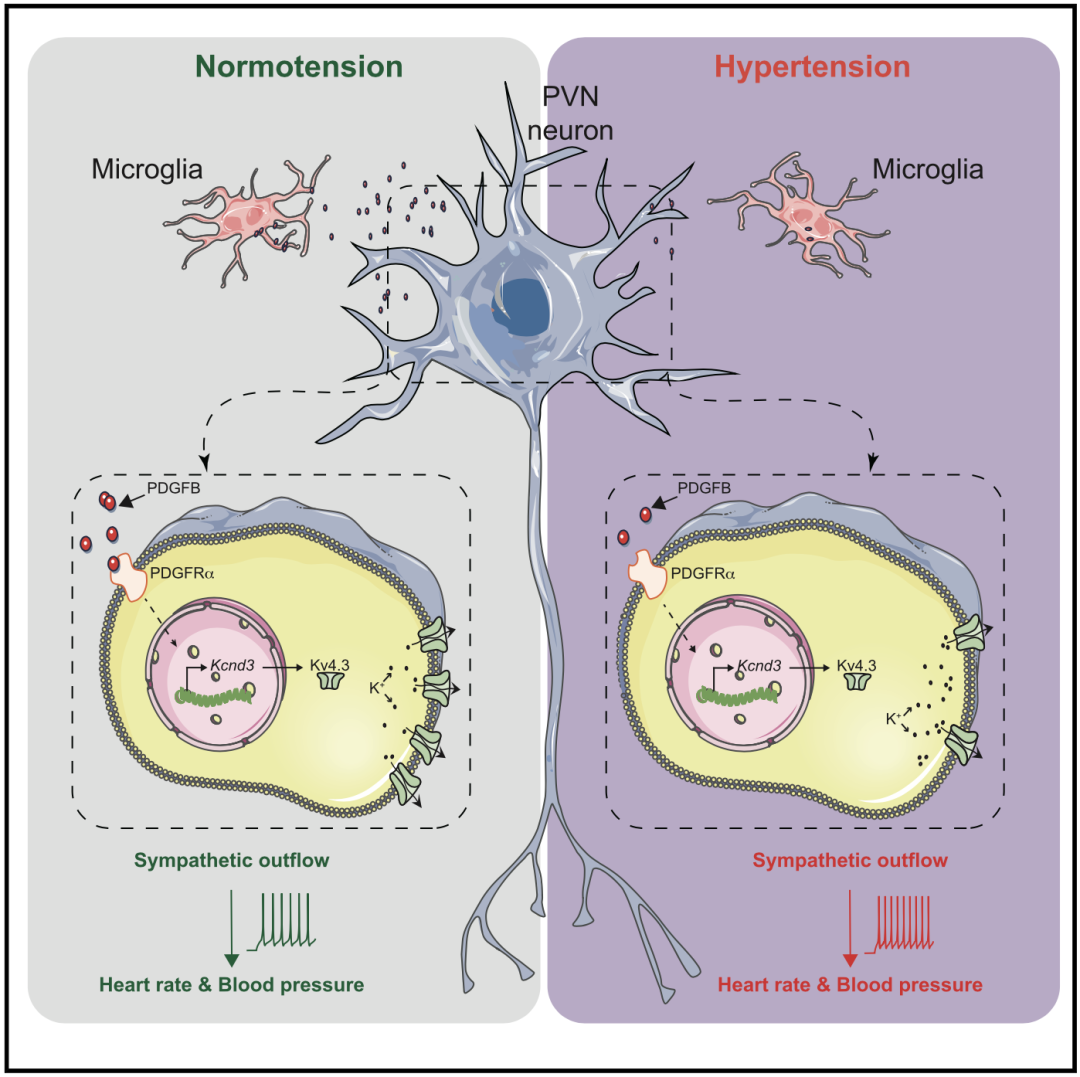
机制示意图
总体而言,这个研究不仅揭示了小胶质细胞可以直接参与调控神经元膜电位,丰富了小胶质细胞的非免疫功能及其与神经元互作的机制;还揭示了交感神经稳态的中枢调控机制,为临床自主神经功能紊乱(如高血压等)的防治提供了崭新思路。
参考资料:
[1].Azizi M, Sanghvi K, Saxena M, et al. Ultrasound renal denervation for hypertension resistant to a triple medication pill (RADIANCE-HTN TRIO): a randomised, multicentre, single-blind, sham-controlled trial. Lancet. 2021;397(10293):2476-2486. doi:10.1016/S0140-6736(21)00788-1
[2].Bi Q, Wang C, Cheng G, et al. Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension. Immunity. 2022;55(8):1466-1482.e9. doi:10.1016/j.immuni.2022.06.018
[3].Spittau B. Aging Microglia-Phenotypes, Functions and Implications for Age-Related Neurodegenerative Diseases. Front Aging Neurosci. 2017;9:194. Published 2017 Jun 14.
doi:10.3389/fnagi.2017.00194
[4].Yang T, Velagapudi R, Terrando N. Neuroinflammation after surgery: from mechanisms to therapeutic targets. Nat Immunol. 2020;21(11):1319-1326. doi:10.1038/s41590-020-0812-1
[5].Schafer DP, Lehrman EK, Kautzman AG, et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 2012;74(4):691-705. doi:10.1016/j.neuron.2012.03.026
[6].Bilimoria PM, Stevens B. Microglia function during brain development: New insights from animal models. Brain Res. 2015;1617:7-17. doi:10.1016/j.brainres.2014.11.032
[7].Wang C, Yue H, Hu Z, et al. Microglia mediate forgetting via complement-dependent synaptic elimination. Science. 2020;367(6478):688-694. doi:10.1126/science.aaz2288
[8].Badimon A, Strasburger HJ, Ayata P, et al. Negative feedback control of neuronal activity by microglia. Nature. 2020;586(7829):417-423. doi:10.1038/s41586-020-2777-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


