科学家揭示了EMT促进乳腺肿瘤的发生和转移的新机制
来源:生物谷原创 2023-07-11 19:29
越来越多的证据表明,癌症干细胞(CSCs)启动肿瘤,尤其是放射和化疗耐药,推动转移和不良预后。干细胞是癌细胞的一个亚群,与干细胞具有自我更新和多潜能的特性。
越来越多的证据表明,癌症干细胞(CSCs)启动肿瘤,尤其是放射和化疗耐药,推动转移和不良预后。干细胞是癌细胞的一个亚群,与干细胞具有自我更新和多潜能的特性。肿瘤中的CSCs可以通过上皮间充质转化(EMT)从非干细胞癌细胞中产生。EMT描述了一个过程,在这个过程中,上皮细胞失去了许多上皮特征,而获得了间质特征。
乳腺癌主要分为雌激素受体(ER)阳性的腔性肿瘤和ER阴性的基底样瘤。基底细胞样乳腺癌(BLBC)分化较差,是最致命的,部分原因是它们富含CSCs。我们和其他人已经证明,至少部分BLBC起源于腔上皮细胞或腔肿瘤细胞。乳腺癌中控制EMT和CSCs的分子机制尚不清楚。

图片来源:https://doi.org/10.1038/s41419-023-05888-9
近日,来自深圳大学健康科学中心的研究者们在Cell Death and Disease杂志上发表了题为“Loss of function of GATA3 regulates FRA1 and c-FOS to activate EMT and promote mammary tumorigenesis and metastasis”的文章,该研究揭示了GATA3功能缺失调节Fra1和c-fos激活EMT促进乳腺肿瘤的发生和转移。
基底细胞样乳腺癌(BLBC)是最具侵袭性的癌症之一,部分原因是它们富含癌症干细胞(CSCs)。乳腺CSCs可以通过上皮-间充质转化(EMT)从管腔型癌细胞分化而来。GATA3维持腔内细胞的命运,其在BLBC中的表达缺失或降低。然而,在小鼠或细胞中缺失GATA3会导致早期死亡或增殖性缺陷。目前尚不清楚GATA3功能缺失如何调节乳腺癌中的EMT和CSCs。
本研究报道,在缺乏细胞周期抑制物p18Ink4c的小鼠中,GATA3的单倍体丢失上调了促进间充质特征的AP-1家族蛋白Fra1,下调了另一种维持上皮命运的AP-1家族蛋白c-Fos,导致EMT激活,促进了乳腺肿瘤的启动和转移。腔内肿瘤细胞中GATA3的耗尽类似地调节EMT激活中的Fra1和c-Fos。
GATA3结合FOSL1(编码FRA1)和FOS(编码c-fos)基因座,抑制FOSL1,激活FOS转录。在GATA3缺陷的肿瘤细胞中,FRA1的缺失或GATA3的重建,而不是c-Fos的重建,可以抑制EMT,防止肿瘤的发生和/或转移。在乳腺癌中,GATA3的表达与FRA1呈负相关,与c-fos呈正相关。低GATA3和FOS,但高FOSL1是BLBC的特点。
总之,这些数据提供了第一个遗传学证据,表明乳腺肿瘤细胞中GATA3功能的丧失激活了FOSL1,促进了间质特征和CSC功能,同时抑制了FOS失去上皮功能。本研究证明,在GATA3缺陷的肿瘤发生和转移中,FRA1是激活EMT所必需的。
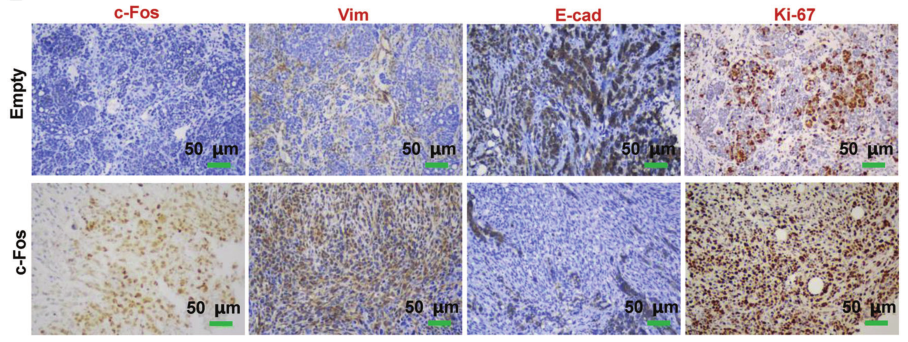
C-Fos在GATA3缺陷肿瘤细胞中的重组刺激Fra1表达并促进肿瘤发生
图片来源:https://doi.org/10.1038/s41419-023-05888-9
在这项研究中,研究者发现在人和小鼠乳腺癌中,GATA3和c-fos在管腔型乳腺肿瘤细胞中优先表达,而在BLBC中很低或不表达。GATA3的缺失下调了c-Fos的表达,激活了EMT,增强了肿瘤的启动潜能。在GATA3缺陷的肿瘤细胞中重组GATA3可以恢复c-Fos的表达,抑制EMT和肿瘤的发生。然而,c-Fos的重建不能恢复GATA3缺陷肿瘤细胞的上皮特征。
这些结果表明,GATA3的缺失抑制了CFos的表达,这至少是肿瘤细胞管腔和/或上皮细胞特征丧失的部分原因,但c-Fos的重建不足以恢复接受EMT的GATA3缺陷肿瘤细胞的管腔和/或上皮特征。
值得注意的是,本研究发现在GATA3缺陷的肿瘤细胞中c-Fos的重建促进了EMT和肿瘤细胞的生长。鉴于研究发现c-fos还反式激活FOSL1的表达,并作为癌基因促进肿瘤细胞生长,c-fos的过度表达促进EMT并加速肿瘤的发展和进展也就不足为奇了。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


