Cell:揭示新冠病毒S蛋白RBD结构域的中和位点和免疫显性位点
来源:本站原创 2020-09-23 19:25
2020年9月23日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。目前人们迫切需要一种有效的预防疫苗来对抗这种病毒。然而,目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MER
2020年9月23日讯/生物谷BIOON/---新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。目前人们迫切需要一种有效的预防疫苗来对抗这种病毒。然而,目前还没有针对SARS-CoV-2的人类疫苗,但大约有120种候选疫苗正在研发中。
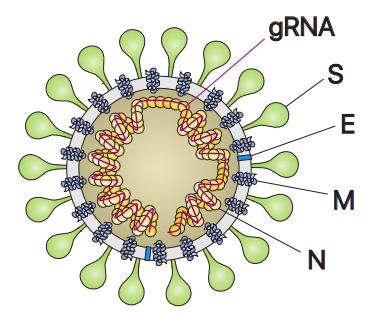
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。
分析SARS-CoV-2感染引起的中和抗体(nAb)的特异性和动力学特征对于理解免疫保护和确定用于疫苗设计的靶标至关重要。
在一项新的研究中,来自美国华盛顿大学和Vir生物技术(Vir Biotechnology)子公司Humabs Biomed SA等研究机构的研究人员在647名SARS-CoV-2感染者的队列中,发现对SARS-CoV-2刺突蛋白和核蛋白(nucleoprotein, NP)的抗体反应强度和中和抗体滴度均与临床评分相关。相关研究结果于2020年9月16日在线发表在Cell期刊上,论文标题为“Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology”。
SARS-CoV-2刺突蛋白的受体结合结构域(RBD)是免疫显性的,也是SARS-CoV-2免疫血清中存在的90%中和抗体的靶点。
尽管整体RBD特异性血清IgG滴度在半衰期为49天的情形下减弱,但是一些个体的nAb滴度和亲合力(avidity)随着时间的推移而增加,这与亲和力成熟(affinity maturation)相一致。
这些研究人员利用单克隆抗体从结构上确定RBD抗原图谱,并对不同RBD表位特异性的血清抗体进行了血清学定量,从而确定了两个主要的受体结合基序抗原位点。这些研究结果解释了受体结合基序的免疫显性,并将会指导COVID-19疫苗设计和药物开发。(生物谷 Bioon.com)
参考资料:
Luca Piccoli et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology. Cell, 2020, doi:10.1016/j.cell.2020.09.037.
SARS-CoV-2与另外两种密切相关的高致病性病毒SARS-CoV和 MERS-CoV同属冠状病毒科β冠状病毒属。SARS-CoV-2有一个大小为30kb的正义、单链RNA基因组。它的核衣壳蛋白(N)和由膜蛋白(M)、包膜蛋白(E)以及刺突蛋白(S)组成的外膜包覆着它的基因组。
与SARS-CoV一样,SARS-CoV-2的S蛋白通过受体结合结构域(RBD)与它们共同的受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.04.011。
分析SARS-CoV-2感染引起的中和抗体(nAb)的特异性和动力学特征对于理解免疫保护和确定用于疫苗设计的靶标至关重要。
在一项新的研究中,来自美国华盛顿大学和Vir生物技术(Vir Biotechnology)子公司Humabs Biomed SA等研究机构的研究人员在647名SARS-CoV-2感染者的队列中,发现对SARS-CoV-2刺突蛋白和核蛋白(nucleoprotein, NP)的抗体反应强度和中和抗体滴度均与临床评分相关。相关研究结果于2020年9月16日在线发表在Cell期刊上,论文标题为“Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology”。
SARS-CoV-2刺突蛋白的受体结合结构域(RBD)是免疫显性的,也是SARS-CoV-2免疫血清中存在的90%中和抗体的靶点。
尽管整体RBD特异性血清IgG滴度在半衰期为49天的情形下减弱,但是一些个体的nAb滴度和亲合力(avidity)随着时间的推移而增加,这与亲和力成熟(affinity maturation)相一致。
这些研究人员利用单克隆抗体从结构上确定RBD抗原图谱,并对不同RBD表位特异性的血清抗体进行了血清学定量,从而确定了两个主要的受体结合基序抗原位点。这些研究结果解释了受体结合基序的免疫显性,并将会指导COVID-19疫苗设计和药物开发。(生物谷 Bioon.com)
参考资料:
Luca Piccoli et al. Mapping neutralizing and immunodominant sites on the SARS-CoV-2 spike receptor-binding domain by structure-guided high-resolution serology. Cell, 2020, doi:10.1016/j.cell.2020.09.037.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


