《神经元》:厦门大学团队破解小胶质细胞感知阿尔茨海默病“毒蛋白”之谜!
来源:奇点糕 2022-12-23 10:16
此项工作首次从生物力学的角度阐Piezo1介导了小胶质细胞对Aβ纤维硬度的机械反应。靶向激活Piezo1可以促进小胶质细胞对Aβ纤维的吞噬作用,进而缓解AD进程。
阿尔茨海默病(AD)好发于老年人群,是一种起病隐匿的神经系统退行性疾病。关于AD发病的具体机制,目前尚不清楚。
主流观点认为,AD的主要病理特征为脑中淀粉样蛋白β(Aβ)所形成的Aβ斑块,以及神经细胞内Tau蛋白磷酸化所导致的神经纤维缠结[1-2]。Aβ斑块由致密核心和外周的Aβ纤维所组成。有研究发现,体外纤维化的Aβ表现出超强的硬度[3]。
作为中枢神经系统的常驻免疫细胞,小胶质细胞可以识别和吞噬Aβ斑块周围紧密包裹的Aβ纤维,阻挡Aβ纤维的向外延伸,进而延缓AD进程[4-5]。值得注意的是,小胶质细胞还具有独特的趋硬特性,可以感应周围组织的硬度并做出响应[6]。不过,纤维化的Aβ是否能调节小胶质细胞对硬度的响应机制,进而影响AD进程,目前仍不清楚。
近日,由厦门大学莫玮、张亮领衔的研究团队,在著名期刊《神经元》上发表重要研究成果[7]。他们发现,Aβ斑块相关组织硬度明显升高,Aβ斑块相关小胶质细胞上机械力受体Piezo1的表达显著上调。小胶质细胞上的Piezo1可感知Aβ纤维的硬度,介导钙粒子内流,促进小胶质细胞聚集、吞噬和压缩Aβ斑块。
他们还发现,缺失Piezo1的小胶质细胞导致了Aβ病理学的加剧和认知能力的下降,而药理性激活Piezo1可改善AD模型小鼠的Aβ形成和认知障碍。此项发现为AD的治疗提供了新的潜在干预靶点。

论文首页图
接下来,让我们看看这项研究是如何展开的。
首先,研究人员通过Methoxy-X04标记AD模型小鼠脑中的Aβ斑块,随后通过原子力显微镜首次在小鼠脑切片中发现,Aβ斑块相关的脑组织(PATs)的机械硬度明显高于非Aβ斑块相关的脑组织(NPATs)。
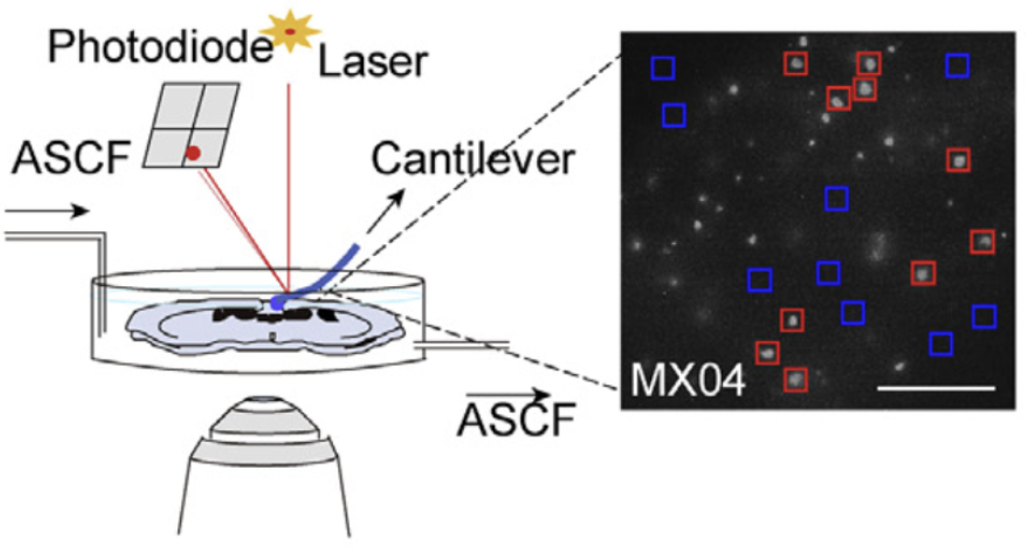
脑切片原子力显微镜测量示意图
大量研究表明,细胞所处微环境中硬度的变化对于细胞功能的转变至关重要[8]。此外,小胶质细胞作为中枢神经系统中最重要的调节细胞之一,其所具备的独特“趋硬特性”可以使其对周围环境中硬度的改变做出响应。因此,研究人员推测,Aβ斑块周围脑组织硬度的变化可能影响了小胶质细胞的功能实现。
先前的研究提示,机械感知蛋白对于细胞对物理刺激的响应至关重要[9]。研究人员分析了已报道的几种机械力感知蛋白在小胶质细胞中的表达情况,发现Piezo1在小胶质细胞中相对其他机械通道蛋白表达最高。
虽然Piezo1作为机械力感受器的作用已在多种细胞中被证实,但其在小胶质细胞中的作用尚不清楚。研究人员发现,在体外原代培养的小胶质细胞中,纤维化Aβ的硬度刺激可显著上调小胶质细胞中Piezo1的水平。通过进一步的钙成像和细胞电生理的实验,研究人员证实,Piezo1通过产生下游电化学信号,维持了小胶质细胞对Aβ斑块硬度的反应性。
此外,在AD病人和AD模型小鼠的脑切片中,研究人员发现Piezo1高表达于Aβ斑块周围的小胶质细胞中。为了进一步探索小胶质细胞中Piezo1在AD进程中的作用,研究人员构建了小胶质细胞Piezo1缺失的AD模型小鼠(Piezo1MG-KO)。与对照组相比,其中Piezo1MG-KO小鼠表现出更严重的AD症状和更广泛的Aβ斑块形成。这说明小胶质细胞Piezo1在缓解AD进程中发挥着重要作用。
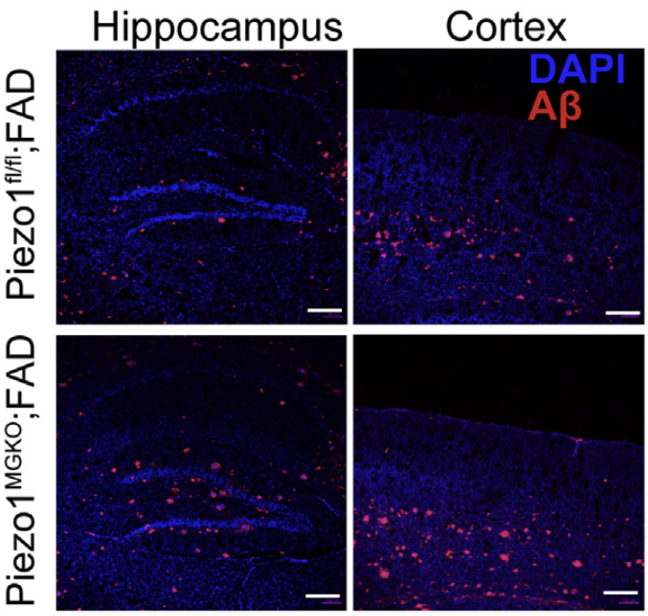
小胶质细胞Piezo1敲除加重了Aβ斑块形成
那么,小胶质细胞Piezo1参与了何种细胞过程,进而影响AD进程呢?研究人员围绕这一问题,对其机制进行了深入探讨。
先前的一项研究表明,Piezo1激活可以明显促进小胶质细胞的吞噬活性,而小胶质细胞的吞噬活性直接影响了Aβ纤维的清除[10]。
因此,为了探究小胶质细胞中Piezo1的缺失是否会影响其吞噬功能,研究人员使用流式细胞术检测了AD小鼠脑中的MX04+CD11b+CD45+细胞群,发现Piezo1MG-KO小鼠中该细胞群所占的比例明显下降。以上结果说明,Piezo1缺失显著降低了小胶质细胞对Aβ纤维的吞噬和清除作用。
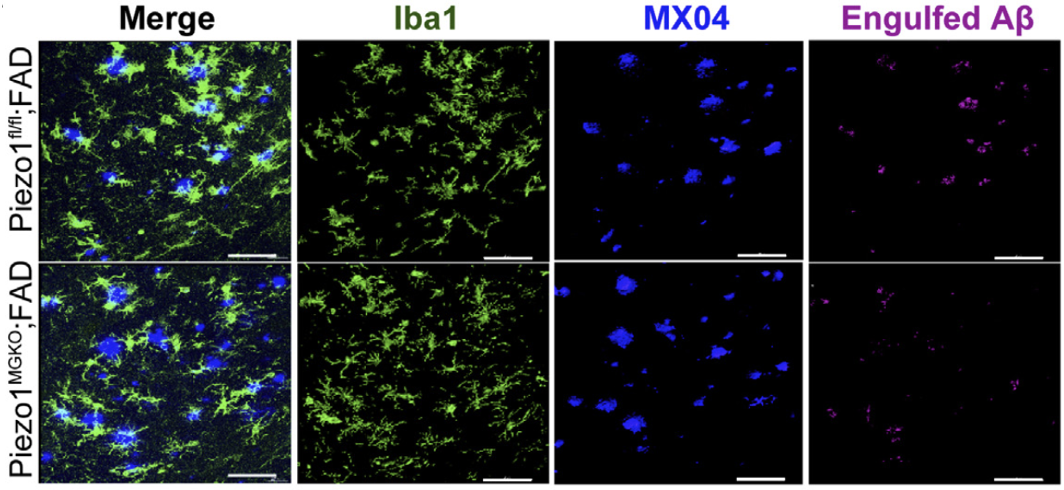
Piezo1敲除抑制了小胶质细胞对Aβ的吞噬
为了进一步探究Piezo1在小胶质细胞中的作用,研究人员分离成年小鼠的小胶质细胞后进行RNA测序和基因集富集分析,发现在Piezo1敲除的小胶质细胞中,细胞骨架动力学、微管的运动和细胞迁移信号通路有关的基因明显下调。
此外,研究人员还发现,Piezo1敲除导致小胶质细胞在Aβ斑块周围的聚集减少,使得Aβ斑块更加趋向松散状态,进而促进了Aβ斑块周围纤维状结构的向外延伸。
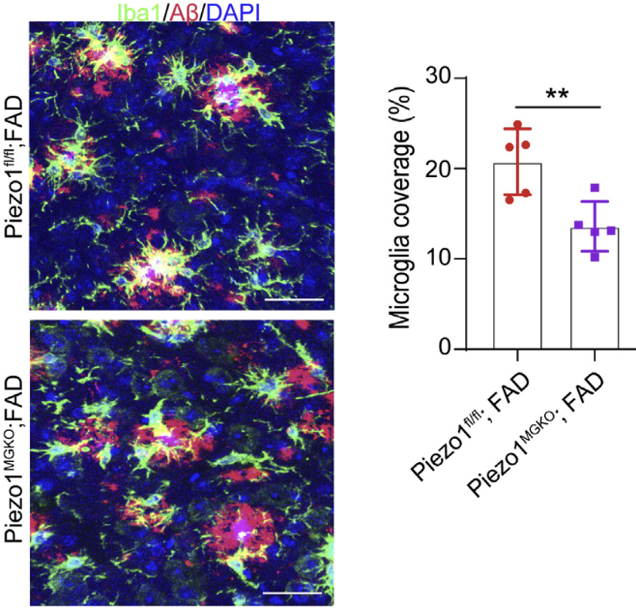
Piezo1敲除导致小胶质细胞在Aβ斑块周围的聚集减少
以上结果提示,Piezo1介导了小胶质细胞对Aβ纤维硬度的机械反应,从而促进其在Aβ斑块周围的聚集和吞噬作用。
最后,为了验证Piezo1在AD治疗中的潜在价值,研究人员使用Piezo1的激动剂Yoda1治疗AD小鼠。结果表明Yoda1明显缓解了AD小鼠的认知障碍和Aβ斑块的形成。
值得注意是的,当敲除小胶质细胞Piezo1后,Yoda1不再具有改善AD症状的治疗作用。以上结果说明,小胶质细胞的Piezo1可能是治疗AD的潜在干预靶点。
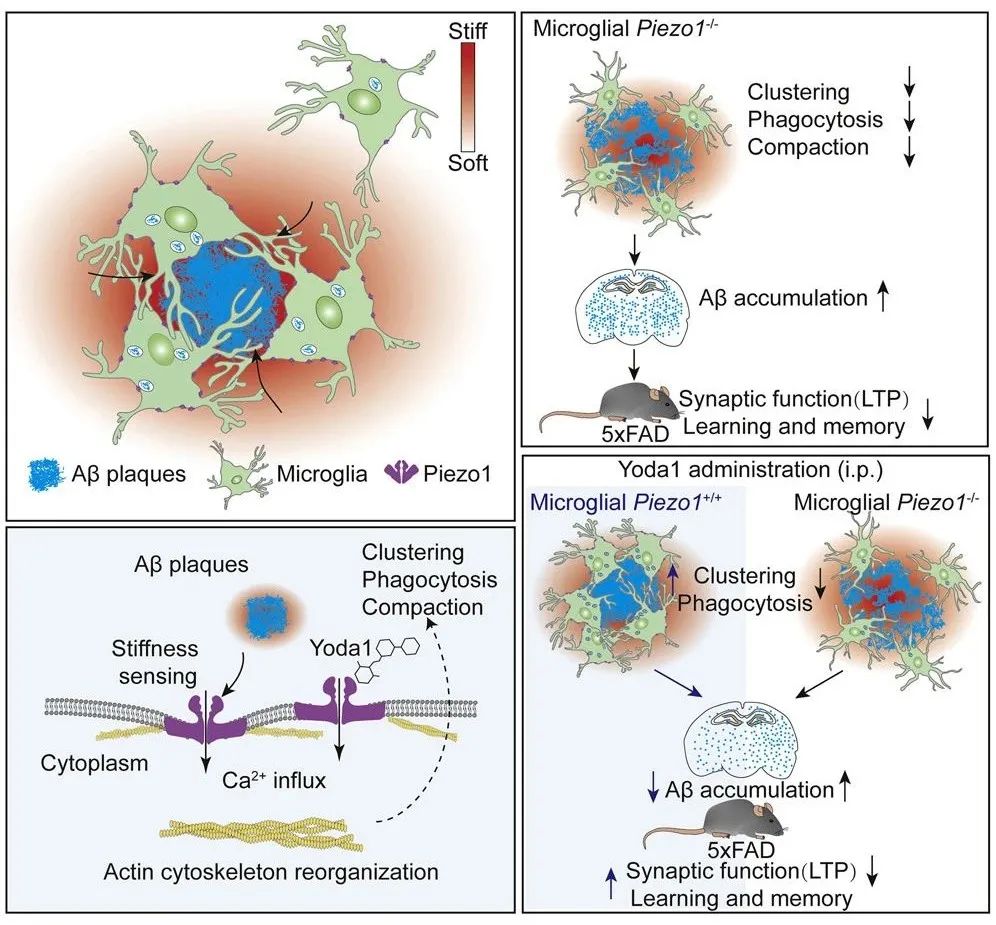
总的来说,此项工作首次从生物力学的角度阐Piezo1介导了小胶质细胞对Aβ纤维硬度的机械反应。靶向激活Piezo1可以促进小胶质细胞对Aβ纤维的吞噬作用,进而缓解AD进程。这一发现也为AD的治疗提供了全新的干预靶点。
参考文献
[1] Bloom GS. Amyloid-β and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurol. 2014;71(4):505-508. doi:10.1001/jamaneurol.2013.5847
[2] Pereira JB, Janelidze S, Ossenkoppele R, et al. Untangling the association of amyloid-β and tau with synaptic and axonal loss in Alzheimer's disease. Brain. 2021;144(1):310-324. doi:10.1093/brain/awaa395
[3] Mattana S, Caponi S, Tamagnini F, Fioretto D, Palombo F. Viscoelasticity of amyloid plaques in transgenic mouse brain studied by Brillouin microspectroscopy and correlative Raman analysis. J Innov Opt Health Sci. 2017;10(6):1742001. doi:10.1142/S1793545817420019
[4] Pereira JB, Janelidze S, Ossenkoppele R, et al. Untangling the association of amyloid-β and tau with synaptic and axonal loss in Alzheimer's disease. Brain. 2021;144(1):310-324. doi:10.1093/brain/awaa395
[5] Condello C, Yuan P, Schain A, Grutzendler J. Microglia constitute a barrier that prevents neurotoxic protofibrillar Aβ42 hotspots around plaques. Nat Commun. 2015;6:6176. Published 2015 Jan 29. doi:10.1038/ncomms7176
[6] Bollmann L, Koser DE, Shahapure R, et al. Microglia mechanics: immune activation alters traction forces and durotaxis. Front Cell Neurosci. 2015;9:363. Published 2015 Sep 23. doi:10.3389/fncel.2015.00363
[7] Hu J, Chen Q, Zhu H, et al. Microglial Piezo1 senses Aβ fibril stiffness to restrict Alzheimer's disease [published online ahead of print, 2022 Nov 8]. Neuron. 2022;S0896-6273(22)00954-0. doi:10.1016/j.neuron.2022.10.021
[8] Ayata P, Schaefer A. Innate sensing of mechanical properties of brain tissue by microglia. Curr Opin Immunol. 2020;62:123-130. doi:10.1016/j.coi.2020.01.003
[9] Delmas P, Hao J, Rodat-Despoix L. Molecular mechanisms of mechanotransduction in mammalian sensory neurons. Nat Rev Neurosci. 2011;12(3):139-153. doi:10.1038/nrn2993
[10] Geng J, Shi Y, Zhang J, et al. TLR4 signalling via Piezo1 engages and enhances the macrophage mediated host response during bacterial infection. Nat Commun. 2021;12(1):3519. Published 2021 Jun 10. doi:10.1038/s41467-021-23683-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


