多氯代甾体天然产物合成研究中获进展
来源:上海有机所 2021-08-26 12:25
含氯天然产物因其独特的生物活性受到有机合成化学家的关注,同时含氯甾体药物作为一类重要的合成甾体在临床上广泛应用,因此发展高效的合成策略实现含氯甾体分子的简洁、精准合成具有重要的研究意义。Clionastatins A和B是意大利科学家Fattorusso等于2004年在海洋穴居海绵Cliona nigricans中分离出的一类多氯代甾体天然产物,
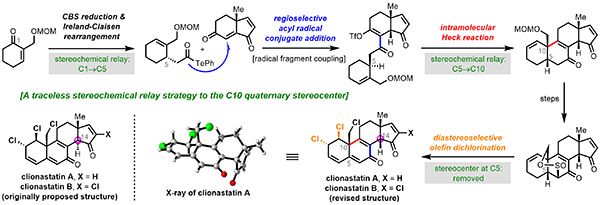
含氯天然产物因其独特的生物活性受到有机合成化学家的关注,同时含氯甾体药物作为一类重要的合成甾体在临床上广泛应用,因此发展高效的合成策略实现含氯甾体分子的简洁、精准合成具有重要的研究意义。Clionastatins A和B是意大利科学家Fattorusso等于2004年在海洋穴居海绵Cliona nigricans中分离出的一类多氯代甾体天然产物,具有良好的抗肿瘤细胞毒性(IC50 = 0.8-2.0 μg/mL)。它们是首例从自然界中分离出的多卤代甾体天然产物,且分子中氯原子不以常见的氯醇形式存在。由于分离得到的天然产物量较少(每个天然产物仅分离得到1 mg左右的样品),其化学结构仅通过核磁谱图确定;同时分离文献中未报道天然产物的单晶结构和核磁碳谱谱图,而仅是通过二维核磁谱图HSQC和HMBC完成了碳谱化学数据的指定,因此其报道的化学结构和碳谱数据的准确性需要进一步通过化学合成的手段鉴定。
中国科学院上海有机化学研究所天然产物有机合成化学院重点实验室桂敬汉课题组致力于活性甾体和萜类天然产物的高效合成研究,以往研究发展了基于骨架可控性重组的仿生合成策略,实现了多个复杂甾体天然产物的高效合成(J. Am. Chem. Soc. 2018, 140, 9413/2019, 141, 5021/2020, 142, 5007/2021, 143, 4886;Angew. Chem. Int. Ed. 2021, 60, 11222)。近日,该课题组报道了多氯代甾体天然产物clionastatins A和B的首次全合成与其结构的修正(J. Am. Chem. Soc. 2021,DOI:10.1021/jacs.1c07511)。基于天然产物结构的分析,研究指出这类天然产物合成的难点在于:根据Furst-Plattner规则,即环己烯的双卤代反应倾向于给出双直立键产物,因此clionastatins中处于准平伏键C1和C2双氯原子的立体选择性引入颇具挑战;分子中存在非常独特、高度不饱和的3,5,8,16-四烯-7,15-双酮结构,易于发生B环的芳构化反应,因此,如何选择合适的时机引入B环的不饱和结构同时避免其发生芳构化反应较为重要;天然产物报道结构的不确定性增加了合成的难度。
研究从已知烯酮化合物出发,CBS还原和Ireland-Claisen重排反应实现了手性酰基自由基前体的制备,并将产生的C1手性立体化学转移至C5位;酰基自由基共轭加成反应和分子内Heck反应构筑了天然产物核心的四环骨架结构,并将C5手性立体化学转移至C10位,得到了正确构型的C10季碳手性中心;亚磺酸内酯底物控制的烯烃双氯代反应引入了挑战性的C1和C2准平伏键双氯原子,脱氢反应消除C5手性中心,以16-17步反应完成了clionastatins A 和B的首次全合成。合成样品的NOE谱图和clionastatin A的单晶结构均显示,天然产物的C/D环是顺式稠合的方式(即C14-H处于β构型),而不是文献报道的反式稠合的结构(即C14-H处于α构型),纠正了文献中错误报道的天然产物结构。整个合成过程中,科研人员使用了无痕立体化学传递(traceless stereochemical relay)的策略,即由CBS还原反应、Ireland-Claisen重排反应和分子内Heck反应实现了C10位季碳手性中心的精准构建。该研究展示了汇聚式合成策略在复杂天然产物合成中的高效性,并体现了天然产物合成目前仍是复杂分子结构鉴定或修正的重要手段。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


