JACS:揭示新型阿尔兹海默病β淀粉样蛋白的多态特性
来源:本站原创 2021-08-16 11:20
2021年8月16日 讯 /生物谷BIOON/ --阿尔兹海默病(AD)是一种会导致痴呆症发生的神经系统疾病,随着患者年龄的增长,其往往会表现出认知、记忆和心里缺陷等,而且病情会不断恶化。虽然目前的治疗方法重点关注在一定程度上缓解患者的疾病症状,但阿尔兹海默病并没有明确的预防或治疗方法,这或许就需要研究人员不断努力来理解该病的生物学特性。致病性β淀粉样(Aβ
2021年8月16日 讯 /生物谷BIOON/ --阿尔兹海默病(AD)是一种会导致痴呆症发生的神经系统疾病,随着患者年龄的增长,其往往会表现出认知、记忆和心里缺陷等,而且病情会不断恶化。虽然目前的治疗方法重点关注在一定程度上缓解患者的疾病症状,但阿尔兹海默病并没有明确的预防或治疗方法,这或许就需要研究人员不断努力来理解该病的生物学特性。
图片来源:Tokyo Tech
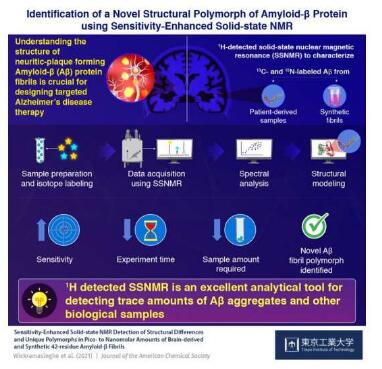
致病性β淀粉样(Aβ)蛋白纤维在大脑中以斑块的形式积累或许是阿尔兹海默病发生的一个标志,因此,解析其结构组织对于设计出靶向性疗法来治疗阿尔兹海默病至关重要;尽管如今研究人员已经报道了Aβ40蛋白的多种不同形式或多态性,但对于更具致病性的Aβ42的理解却很少,此外,利用标准的分析技术从少量样本中识别出微量的Aβ,对于科学家们而言仍然是一大挑战。
近日,一篇发表在国际杂志Journal of the American Chemical Society上题为“Sensitivity-Enhanced Solid-State NMR Detection of Structural Differences and Unique Polymorphs in Pico- to Nanomolar Amounts of Brain-Derived and Synthetic 42-Residue Amyloid-β Fibrils”的研究报告中,来自日本理化研究所等机构的科学家们通过研究分析了固态核磁共振(SSNMR,solid-state nuclear magnetic resonance)光谱技术在解析Aβ及其相关致病性纤维的原子级结构差异上的适用性,这种强大的分析技术能够测定原子核在磁场和电场影响下的不同行为和特性,这或许就能突出其原子结构。
研究者Ishii表示,尽管Aβ42纤维在病理学上非常重要,但在生理相关条件下制备的Aβ42纤维的结构变化的信息非常有限;本文研究中,研究人员阐明了,利用1H(氢同位素)检测的SSNMR技术在分析患者衍生的以及合成性的Aβ纤维方面的应用,因为其数量非常有限,能低至皮摩尔至纳摩尔。在传统上用于结构特征分析的13C(碳同位素)检测的SSNMR技术需要大量样本,并且在制备均匀的样本上存在一定困难。鉴于较高的灵敏性以及容易分析生物样本中的微量成分,研究人员使用了灵敏度增强的1H检测SSNMR技术来进行分析。来自阿尔兹海默病患者机体的合成性纤维和大脑衍生的Aβ能在特定的氨基酸残基上被标记为同位素13C和15N,从而就能增强检测的灵敏性、原子分辨率以及对特定部位进行结构分析。
图片来源:https://pubs.acs.org/doi/10.1021/jacs.1c03346
研究人员使用上述方法就能成功分析Aβ42的一种新的多态性,仅需要对42 nmol的Aβ进行分析,而且要比此前使用的浓度低25-100倍;此外,灵敏度的提高就能大大减少获得样品光谱所需要的的时间;通过这种技术所获得的光谱位置显示,蛋白质主干的结构以及侧链的排列与此前报道的或许并不相同。总的来讲,本文研究结果阐明了参与致病性Aβ42纤维的分子接触,从而就为开发新型治疗性策略铺平了道路,而且这些策略也能靶向作用驱动阿尔兹海默病进展的毒性聚集物的产生。
最后研究者总结道,本文研究证明了Aβ42或会在大脑和合成性制剂中形成多样化的纤维结构,相关研究结果或为后期科学家们分析微量的生物样本提供新的路径,比如淀粉样纤维和低聚物等,而13C检测的SSNMR技术则可能会变得无效。综上,本文研究结果或能帮助科学家们理解复杂疾病的发病机制,这种Aβ42纤维或能展现出一种新型折叠的活多态性的结构。(生物谷Bioon.com)
原始出处:
Ayesha Wickramasinghe,Yiling Xiao,Naohiro Kobayashi, et al. Sensitivity-Enhanced Solid-State NMR Detection of Structural Differences and Unique Polymorphs in Pico- to Nanomolar Amounts of Brain-Derived and Synthetic 42-Residue Amyloid-β Fibrils, Journal of the American Chemical Society (2021). DOI: 10.1021/jacs.1c03346
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。