遗传性失明患者新希望!首次通过LNP靶向感光细胞,已在非人灵长类动物中获积极结果
来源:生辉 2023-01-17 09:59
本次研究确定了一种使用肽缀合的 LNP,通过该递送系统能够向神经视网膜靶向递送 mRNA。与此同时,在非人灵长类动物获得的积极试验结果将具备更富前景的临床转化潜能。
过去几年间,在新冠疫情全球蔓延的背景之下,基于 mRNA 构建起的强大递送技术成为众人瞩目的焦点,其凭借优秀的临床有效性和快速响应的能力在生物医药领域掀起一阵热潮。近日,基于 mRNA 与脂质纳米颗粒(LNP)载体技术,一种新的基因疗法可能为遗传性视网膜疾病(IRD)患者带来更多选择。
2023年1月11日,来自美国俄勒冈州立大学和俄勒冈健康与科学大学(OHSU)的研究人员在 Science Advances 期刊发表了题为:Peptide-guidedlipidnanoparticlesdeliver mRNAto theneural retinaof rodentsand nonhumanprimates 的研究论文。
研究团队成功发现了一种能够靶向眼内光感受器(PR)的肽序列,通过将其与脂质纳米颗粒结合,新的 LNP 递送系统首次成功靶向动物的眼内感光细胞,并将 mRNA 递送至小鼠以及非人类灵长类动物的神经视网膜中。

当前研究已经发现,至少存在超过 250 种的基因突变与遗传性视网膜疾病有关,但目前只有一种基因疗法获得批准。因此,针对一些早期的基因治疗技术进行改进可以提供更多的治疗选择。该研究的共同作者、来自 OHSU 医学院的眼科助理教授兼 Casey 眼科研究所科学家 Renee Ryals 表示,此次研究结果表明,脂质纳米颗粒可以帮助我们做到这一点。
首次成功靶向动物眼内光感受器
遗传性视网膜疾病(IRD)是一组由遗传因素引起的视网膜疾病的统称。该类疾病可由与视网膜病理学相关的 300 余种不同的基因突变引起,这些基因的正确表达对于光感受器(PR)和视网膜色素上皮(RPE)功能而言至关重要。一旦这些基因不能正确表达,就会导致进行性的细胞死亡从而使患者失明。
对于该类遗传疾病而言,最理想、最有效的治疗方式莫过于通过基因增强、编辑或沉默等技术纠正致病基因。然而在此前研究中,由 LNP 介导的 mRNA 递送仅限于视网膜色素上皮细胞(RPE)和 Müller 胶质细胞。无论是通过视网膜下还是玻璃体内递送,LNP 都无法穿透神经视网膜,这就成为了它们将基因或基因编辑器递送至光感受器(PR),也是最重要的细胞靶标之一的重要阻碍。
在本次研究中,研究团队克服了此前使用脂质纳米颗粒(LNP)递送遗传物质的主要限制——让它们到达眼睛后部,也就是视网膜所在的位置。经过改良的脂质纳米颗粒能够穿透神经视网膜并将 mRNA 传递给感光细胞,从而恢复感光细胞的正常功能。
对此,科学家首先使用一个基于 M13 噬菌体的七聚体肽文本库来鉴定出能够在体内结合到神经视网膜的肽序列,然后使用筛选出的化学合成肽对于 LNP 递送载体进行修饰。将经过 TAMRA 染料标记的肽配体 LNP 注射在小鼠的玻璃体内之后,能够在视网膜中观察到 TAMRA 染料。在此之后,进一步确定携带 0.15% 和 0.3% 的肽配体 LNP 具有最佳的 mRNA 递送效果。结果表明,该递送系统成功定位并且能够将治疗性 mRNA 递送至小鼠的光感受器(PR)、视网膜色素上皮细胞(RPE)和 Müller 神经胶质细胞。
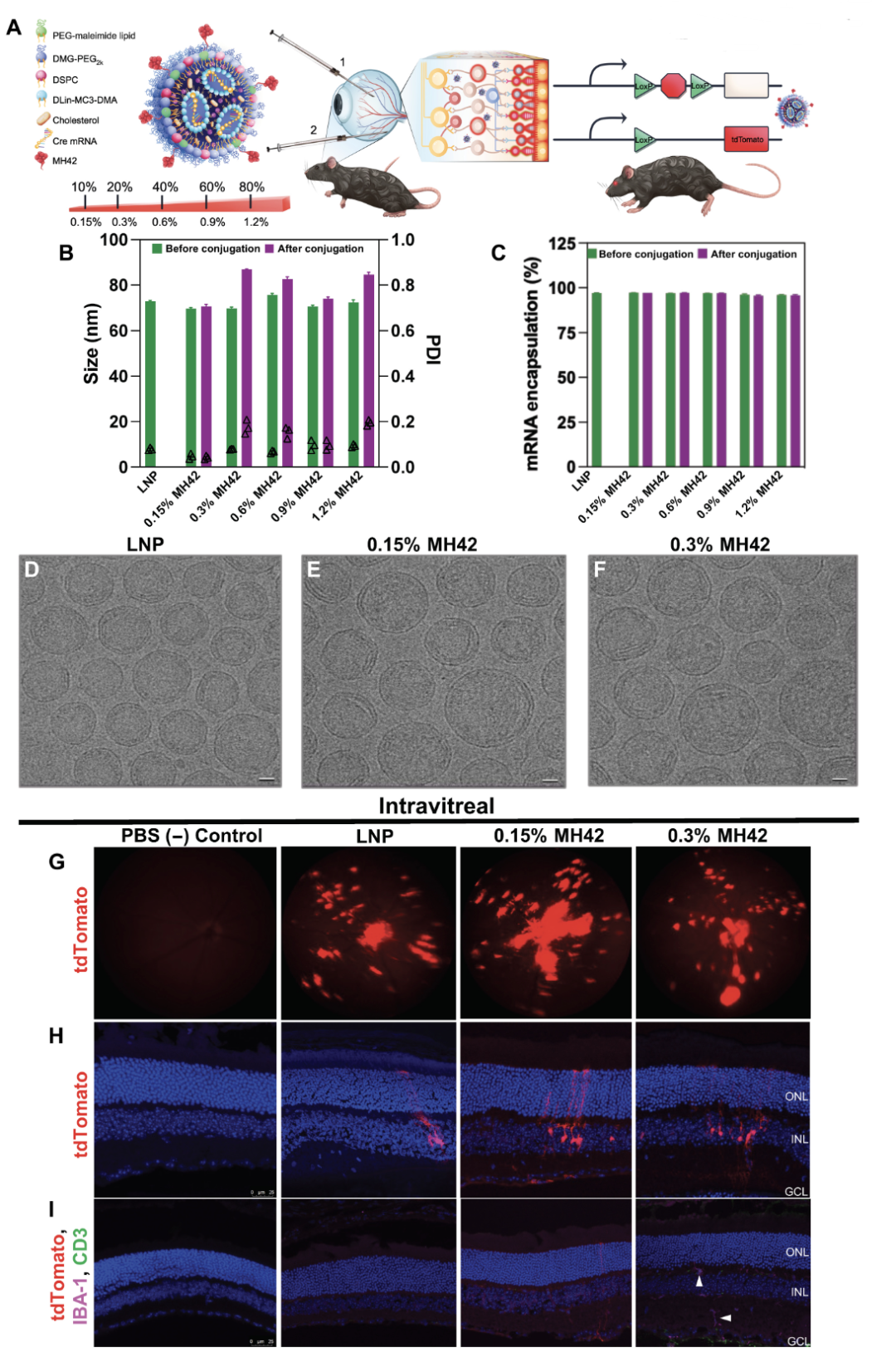 在小鼠体内注射 TAMRA 标记的候选肽
在小鼠体内注射 TAMRA 标记的候选肽
在此之后,研究团队分别向小鼠和恒河猴的眼睛中进行注射治疗。通过多种成像技术检查发现,受试动物的视网膜组织发出绿色荧光,这表明脂质纳米颗粒确实到达了光感受器,并且其递送的 mRNA 成功进入视网膜并且产生了绿色荧光蛋白。上述结果表明,脂质纳米颗粒能够在非人类灵长类动物中靶向光感受器,这代表了 LNP-mRNA 递送技术的一项新的突破。
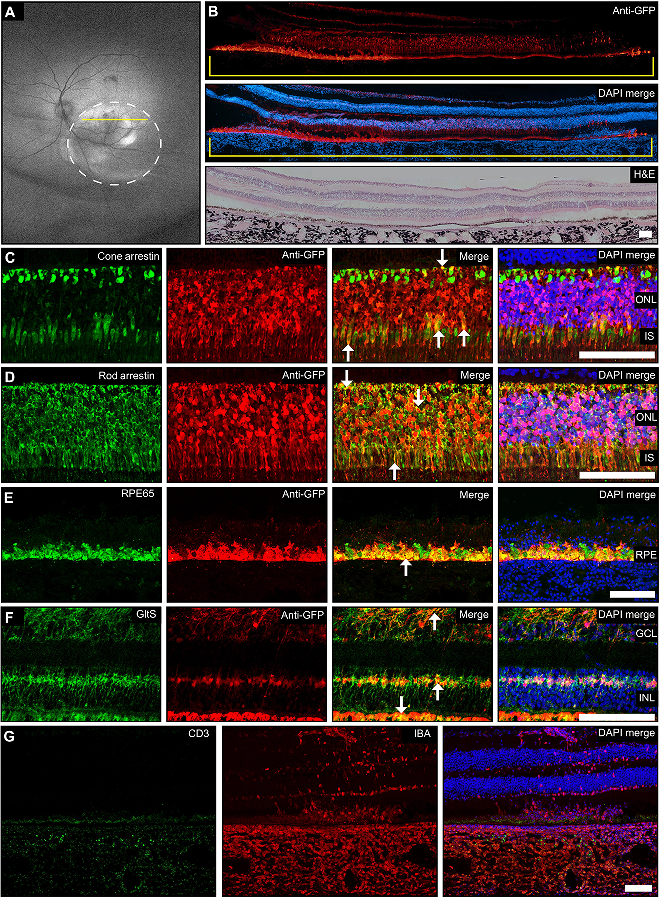 缀合 LNP 在非人类灵长类动物视网膜下给药后介导神经视网膜中的表达
缀合 LNP 在非人类灵长类动物视网膜下给药后介导神经视网膜中的表达
总体而言,本次研究确定了一种使用肽缀合的 LNP,通过该递送系统能够向神经视网膜靶向递送 mRNA。与此同时,在非人灵长类动物获得的积极试验结果将具备更富前景的临床转化潜能。
我们发现了一组可以到达眼睛后部的新型肽,这些肽就像一个邮政编码,而脂质纳米粒子类似于一个信封,我们可以像发送邮件一样“发送”基因疗法,该研究的通讯作者、俄勒冈州立大学药学院副教授 Gaurav Sahay 博士解释道,这种肽能够确保将 mRNA 精确地输送到光感受器——直到现在才能够用脂质纳米颗粒靶向的细胞。
使用LNP替代AAV,解决应用限制难题
事实上,早在 2017 年,美国 FDA 已经批准了首个用于治疗由双等位基因 RPE65 突变引起的遗传性视网膜疾病的基因疗法 Luxturna(voretigene neparvovec-rzyl)。
Luxturna 由基因疗法制造商 Spark Therapeutics 开发,该疗法使用腺相关病毒载体(AAV2),将 RPE65 基因的正常拷贝传递至视网膜色素上皮细胞(RPE)。Luxturna 获批之后,来自美国俄勒冈州的一名 4 岁男童 Caspian 在 OHSU 的 Casey 眼科研究所接受了治疗。在第一次手术后仅仅两周,Caspian 的父母就发现他的视力已经有所改善,并且能够参观博物馆,甚至能够看到夜空中飞过的闪烁的飞机。
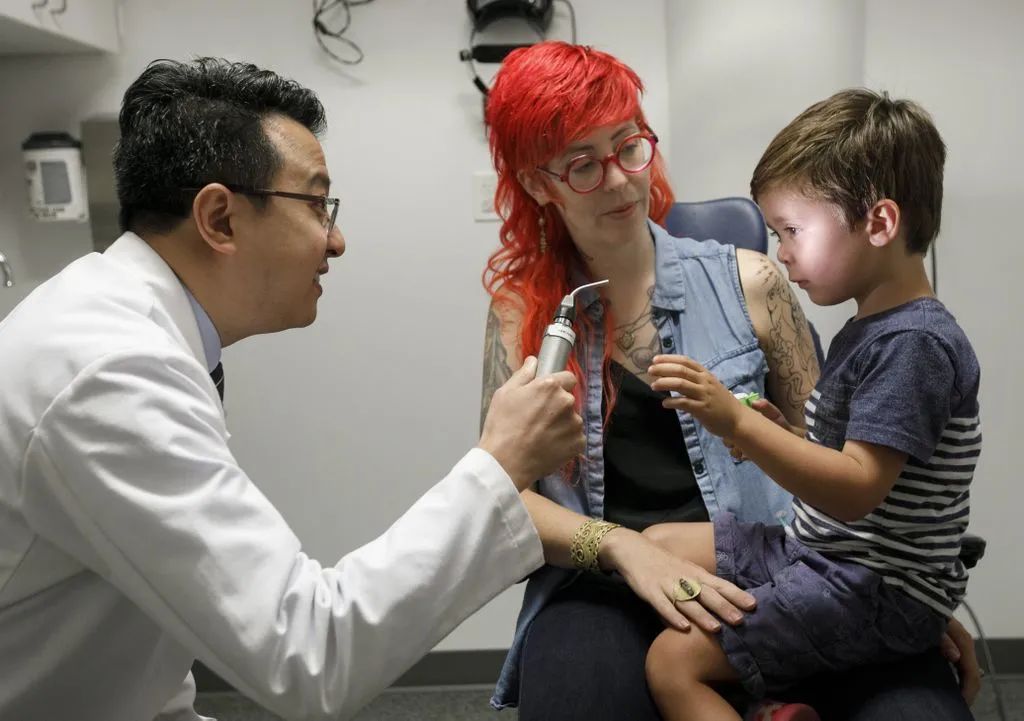
Caspian 在 OHSU 的 Casey 眼科研究所接受治疗(来源:OHSU)
不可否认的是,AAV 递送系统促进了针对视网膜疾病开展基因编辑治疗的有效进展。在 Luxturna 之后,陆续又有 5 项基因疗法产品获得了 FDA 批准,并且这些疗法均是基于腺病毒载体、慢病毒载体和 AAV 载体构建。然而 Sahay 和 Ryals 认为,该类递送系统仍然存在较大局限性,因此积极开展了基于 LNP 递送系统的基因疗法开发工作。
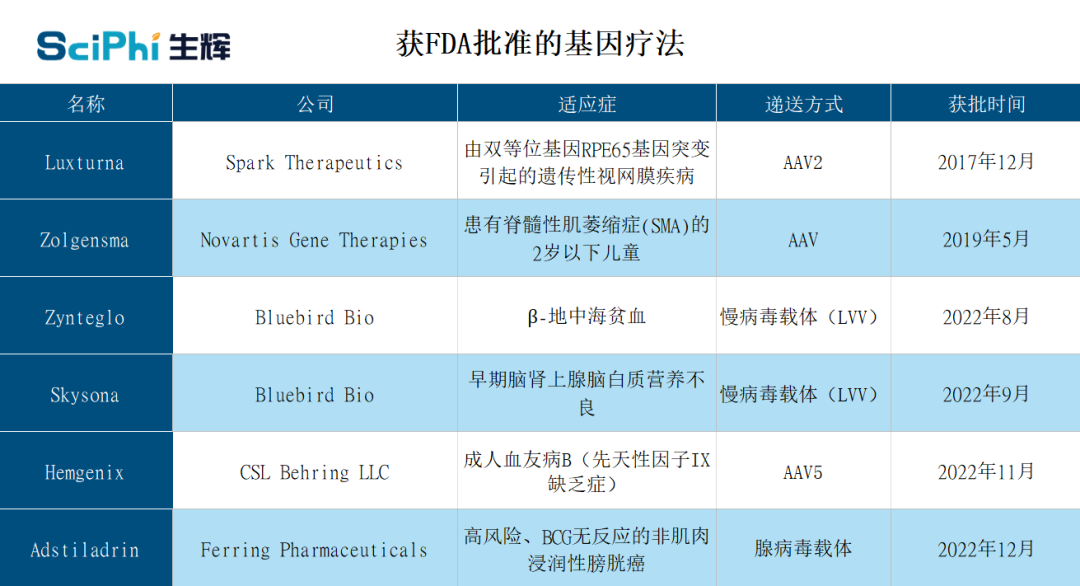
当前获批的基因疗法(来源:生辉整理)
Sahay 解释道,与 LNP 相比,AAV 的包装能力十分有限,并且具备一定的免疫原性。除此之外,它对于编辑工具 Cas9 核酸酶的表达也表现不佳。这些问题突出了开发下一代视网膜基因传递载体的迫切需要,我们希望利用自身对于 LNPs 的了解来开发一种改进的基因编辑器传递系统。
LNP 不仅在安全性方面获得了临床上的一致认可,其模块化的系统也能够允许封装更大尺寸的疗法序列。并且其作为一种合成的可生物降解的化学物质,能够有效降低体内发生的免疫反应。
目前,Sahay 和 Ryals 的团队已经从美国国家眼科研究所获得了 320 万美元的资金,用于继续研究脂质纳米颗粒在治疗遗传性失明方面的前景。他们将基于 LNP 提供一种新的基因编辑工具,从而删除感光细胞中的致病基因并将其替换成为功能正常的基因。
研究团队指出,我们的长期目标是为 IRD 开发相应的 LNP 基因编辑疗法平台。理想情况下,基因编辑器将以 mRNA 的形式提供,并且通过核酸酶的稳定和瞬时表达,以减轻脱靶效应。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


